西北大学:《中级无机化学》课程教学课件(专题讲稿)28 对Cu的价态稳定性的热力学讨论(PPT)

对Cū的价态稳定性的热力学讨论 关于Cu的价态已经知道有两点: (1)CuI能在固体或配离子中稳定存在,但在水溶液,Cu+却 没有Cu+稳定,Cu+可以歧化为Cu+和Cu (2)Cu1在气态稳定,CuⅡ在溶液稳定。 这是什么原因?因为Cu2+的电子构型为d9,而Cu+为d0,难道全 满的结构还不如未充满结构稳定吗?研究一下下面的两个循环。 在气态时: Ai,H(Cu) 2Cu*(g)- +Cu2*(g)+Cu(s) ① △,H8(①】 -Ai H(Cu) -△umH8(Cu) Cu(g) A,H8(①)=(△,H-△H8-△.Ha)cu =(1957-745.6-339.3)mol1=872.1kmol-1 显然,在气态时,Cu+的歧化趋势极小,造成Cu+离子稳定 的决定因素是Cu的第二电离能比第一电离能和金属的原子化焓之 和大得多之故
关于Cu的价态已经知道有两点: (1) CuⅠ能在固体或配离子中稳定存在,但在水溶液,Cu+却 没有Cu2+稳定,Cu+可以歧化为Cu2+和Cu; (2) CuⅠ在气态稳定,CuⅡ在溶液稳定。 这是什么原因? 因为Cu2+的电子构型为d 9 , 而Cu+为d 10 , 难道全 满的结构还不如未充满结构稳定吗?研究一下下面的两个循环。 显然,在气态时,Cu+的歧化趋势极小,造成Cu+离子稳定 的决定因素是Cu的第二电离能比第一电离能和金属的原子化焓之 和大得多之故。 在气态时: 对Cu的价态稳定性的热力学讨论

在水溶液中 △5Ha(Cu) Cu*(g) Cu2+(g) -△H8(Cu) AHa(②) H(Cu2) 2Cu*(aq) Cu2+(aq)+Cu(s) ② -△H8(Cu*) AH(Cu) AI H(Cu) Cu*(g) Cu(g) △,H8(②)=-2△,Ha(Cu*)+△hH(Cu2+)+(△,Ha-△,Ha -△aHa)(Cu) =△,H8(Cu2+)-2△hH(Cu)+△Ha(①) ={-2100-2(-592.9)+872.1 ikJ.mol1=-42.1 kJ.mol- 表明:在水溶液中,Cu+很容易歧化为Cu+和Cu。这是由 于Cu+的水合焓很大,它补偿了Cu+气态歧化反应焓变的正值 和水合一价Cu+(aq)离子的脱水焓后还有剩余,从而改变了反应 自发进行的方向
在水溶液中 表明:在水溶液中,Cu+很容易歧化为Cu2+和Cu。这是由 于Cu2+的水合焓很大,它补偿了Cu+气态歧化反应焓变的正值 和水合一价Cu+(aq)离子的脱水焓后还有剩余,从而改变了反应 自发进行的方向
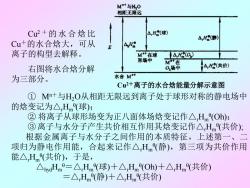
MM+与H20 相距无限远 Cu2+的水合焓比 △,H(球) AH(静) Cu+的水合焓大,可从 498 离子的构型去解释。 M+在球 H(O) 形场中 MT+在 右图将水合焓分解 0场中 △,H(共价) 为三部分。 水合M Cu2+离子的水合焓能量分解示意图 ①M+与HO从相距无限远到离子处于球形对称的静电场中 的焓变记为△Hm(球): ②将离子从球形场变为正八面体场焓变记作△Hm(Oh): ③离子与水分子产生共价相互作用其焓变记作△Hm(共价): 根据金属离子与水分子之间作用的本质特征,上述第 一、 项归为静电作用能,合起来记作△H(静),第三项为共价作用 能△Hm(共价),于是, △hydHm=△Hm(球)十△Hm(Oh)十△,Hm(共价) =△Hm(静)十△Hm(共价)
Cu2 + 的水合焓比 Cu+的水合焓大,可从 离子的构型去解释。 右图将水合焓分解 为三部分。 ① Mn+与H2O从相距无限远到离子处于球形对称的静电场中 的焓变记为△rHm θ (球); ② 将离子从球形场变为正八面体场焓变记作△rHm θ (Oh); ③离子与水分子产生共价相互作用其焓变记作△rHm θ (共价); 根据金属离子与水分子之间作用的本质特征,上述第一、二 项归为静电作用能,合起来记作△rHm θ (静),第三项为共价作用 能△rHm θ (共价),于是, △hydHm θ=△rHm θ (球)+△rHm θ (Oh)+△rHm θ (共价) =△rHm θ (静)+△rHm θ (共价) Cu2+离子的水合焓能量分解示意图
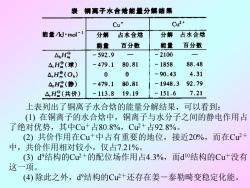
钢离子水合培能量分解结果 Cu* Cu2+ 能量kJ'mol-1 分解 占水合焙 分解占水合焙 能量 百分数 能量 百分数 AH -592.9 -2100 △.H8(球) -479.1 80.81 -1858 88.48 △,HR(Ob) 0 0 -90.43 4.31 △,H品(静) -479.1 80.81 -1948,3 92.79 △H(共价) -113.8 19.19 -151.6 7.21 上表列出了铜离子水合焓的能量分解结果,可以看到: (1)在铜离子的水合焓中,铜离子与水分子之间的静电作用占 了绝对优势,其中Cu+占80.8%,Cu2+占92.8%。 (2)共价作用在Cu+中占有重要的地位,接近20%,而在Cu2+ 中,共价作用相对较小,仅占7.21%。 (3)d9结构的Cu2+的配位场作用占4.3%,而d10结构的Cu+没有 这一项。 (4)除此之外,d9结构的Cu2+还存在姜一泰勒畸变稳定化能
上表列出了铜离子水合焓的能量分解结果,可以看到: (1) 在铜离子的水合焓中,铜离子与水分子之间的静电作用占 了绝对优势,其中Cu+占80.8%,Cu2+占92.8%。 (2) 共价作用在Cu+中占有重要的地位,接近20%,而在Cu2+ 中,共价作用相对较小,仅占7.21%。 (3) d 9结构的Cu2+的配位场作用占4.3%,而d 10结构的Cu+没有 这一项。 (4) 除此之外,d 9结构的Cu2+还存在姜-泰勒畸变稳定化能

综上所述,在水溶液中,Cu2+(aq)比Cu+(aq)稳定 的主要原因是因为C2+与水的静电作用远大于Cu+。 其根源有两个: 一是Cu2+比Cu+的电荷大一倍,离子半径又小于Cu+。 二是Cū2+为d'结构,在水分子配位场的作用下,发生d轨 道能级分裂,得到配位场稳定化能和姜泰勒畸变稳定化能。 因此,尽管Cu+离子的共价作用能大于Cu2+,但由 于Cu2+具有上述特有的因素,因而使得在极性溶剂水 中,Cu2+的水合能远比Cu+大,大到足够破坏Cu+的do 相对稳定的电子构型,使之向d9电子构型的Cu2+转变
综上所述,在水溶液中,Cu2+(aq)比Cu+(aq)稳定 的主要原因是因为Cu2+与水的静电作用远大于Cu+ 。 其根源有两个: 一是Cu2+比Cu+的电荷大一倍, 离子半径又小于Cu+ 。 二是Cu2+为d 9结构, 在水分子配位场的作用下, 发生d轨 道能级分裂,得到配位场稳定化能和姜泰勒畸变稳定化能。 因此,尽管Cu+离子的共价作用能大于Cu2+ ,但由 于Cu2+ 具有上述特有的因素,因而使得在极性溶剂水 中,Cu2+的水合能远比Cu+大,大到足够破坏Cu+的d 10 相对稳定的电子构型,使之向d 9电子构型的Cu2+转变

溶剂化能对Cu的各种氧化态的稳定性的影响,还可从Cu 在乙腈中的电势图得到证实。 1.242 -0.118 在乙腈中 Cu2+ Cu+ Cu 0.562 0.158 0.522 (比较)在水中 Cu2+ Cut 0.3402 在乙腈中,p右<p左,Cu+已己经不能歧化。这是因为在 极性较弱的乙腈溶剂中,离子与溶剂间的静电作用比在水中时 明显减弱,因而Cu2+溶剂化所放出的能量不足以补偿Cu+的去 溶剂化能和电离能,以致Cu+可以稳定存在。 此外,如果配体与铜离子之间所形成的键的共价成分大, 则Cu+就比Cu2+稳定,如CuCI、Cul、Cu(CN)2-等,由于Cut 离子与配体间的作用力大,因而他们都能稳定存在。相反,如 果配体与Cu+离子之间的静电作用大,则Cu+就可以稳定存 在,如CuF,就是如此
溶剂化能对Cu的各种氧化态的稳定性的影响,还可从Cu 在乙腈中的电势图得到证实。 1.242 -0.118 在乙腈中 Cu2+ Cu+ Cu 0.562 0.158 0.522 (比较) 在水中 Cu2+ Cu+ Cu 0.3402 在乙腈中,φ右 θ< φ左 θ ,Cu+已经不能歧化。这是因为在 极性较弱的乙腈溶剂中,离子与溶剂间的静电作用比在水中时 明显减弱,因而Cu2+溶剂化所放出的能量不足以补偿Cu+的去 溶剂化能和电离能,以致Cu+可以稳定存在。 此外,如果配体与铜离子之间所形成的键的共价成分大, 则Cu+就比Cu2+稳定,如CuCl、CuI、Cu(CN)2 -等,由于Cu+ 离子与配体间的作用力大,因而他们都能稳定存在。相反,如 果配体与Cu2+离子之间的静电作用大,则Cu2+就可以稳定存 在,如CuF2就是如此
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)27 配合物稳定性的热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)26 自由能-氧化态图及其应用.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)25 过渡系元素的磁性(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)24 离子型化合物的稳定性——大大及小小规则(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)23 电极电势的热力学讨论、氧化还原反应(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)22 电势-pH图及其应用.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)21 元素电势图及其应用.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)20 对第一过渡系元素的氧化还原性的讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)01 镧系元素的性质及其性质递变规律性(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)19 对镧系元素氧化态度热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)18 多重平衡与化学计算(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)17 键焓及其共价型物质的热化学性质(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)16 晶格能及其应用(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)15 离子盐类溶解性的热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)13 配体强场对元素氧化态稳定性的影响(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)12 硼烷化学(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)11 平衡态和标准态(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)10 热力学稳定性和动力学稳定性(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第八章 d区过渡元素(叙述化学).ppt
- 西北大学:《中级无机化学》课程教学课件(PPT讲稿)第十章 f 区过渡元素.ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)29 关于Cu、Ag、Au和Zn、Cd、Hg活泼性的讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)02 自由能变和标准自由能变(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)03 周期反常现象(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)05 无机化学中的热力学问题(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)06 无机化学中的耦合现象(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)07 无机化学中常见图形简介(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)08 无机高分子(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)09 热力学研究在无机化学中的应用(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)04 无机碳化学(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)14 配合物的电子光谱(PPT).ppt
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第一章 绪论 Physical Chemistry.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第二章 热力学第一定律 The First Law of Thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第三章 热力学第二定律 Second law of thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第五章 化学平衡 Chemical equilibrium.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第四章 多组分系统热力学.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第六章 相平衡.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第七章 电化学.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第九章 统计热力学初步 Foundations of Statistical Thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十一章 化学动力学 chemical kinetics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十二章 胶体系统与粗分散系统 colliod and coarse dispersed system.pdf
