上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第三章 热力学第二定律 Second law of thermodynamics

第三章 热力学第二定律 不可能把热从低温物 体传到高温物体,而 不引起其它变化 Clausius The Second Law of Termodynantics
第三章 热力学第二定律 不可能把热从低温物 体传到高温物体,而 不引起其它变化 Clausius

3.1 热力学第二定律 Second law of thermodynamics 3.1.1.自发过程 自然界中任一孤立系统中,不论发生什么变 化,变化前后的内能总和不变;但是不是任何内 能总和保持不变的任何变化,均能在孤立系统中 发生。 自然界中实际发生的一切变化,即自发过程 (spantaneous process),都不会在原来发生变化影响 所及的各物体所组成的孤立系统中反过来进行
3.1.1.自发过程 Second law of thermodynamics 3.1 热力学第二定律 自然界中任一孤立系统中,不论发生什么变 化,变化前后的内能总和不变;但是不是任何内 能总和保持不变的任何变化,均能在孤立系统中 发生。 自然界中实际发生的一切变化,即自发过程 (spantaneous process),都不会在原来发生变化影响 所及的各物体所组成的 孤立系统中反过来进行

自然界中任一孤立系统中所实际发生 了的变化,如果引入另外的物体加入这一弧 立系统,则原来的变化,一般可以复原,但 却引起了新引进物体的变化。这个新引进的 变化。当然还可以引进又一组新物体,使它 复原,但这又一组新物体又将发生变化。 自然界中任一孤立系统中所实际发生的 变化,都是不可逆变化,与不可逆变化的方向 相反的变化,在原弧立系统中永远不可能发 生
自然界中任—孤立系统中所实际发生 了的变化,如果引入另外的物体加入这一弧 立系统,则原来的变化,一般可以复原,但 却引起了新引进物体的变化。这个新引进的 变化。当然还可以引进又一组新物体,使它 复原,但这又一组新物体又将发生变化。 自然界中任一孤立系统中所实际发生的 变化,都是不可逆变化,与不可逆变化的方向 相反的变化,在原弧立系统中永远不可能发 生

自发变化的共同特征 自发变化某种变化有自动发生的趋势,一旦发生就 无需借助外力,可以自动进行,这种变化称为自发变 化 自发变化的共同特征一不可逆性任何自发变化的逆 过程是不能自动进行的。例如: (1) 焦耳热功当量中功自动转变成热; (2) 气体向真空膨胀; (3) 热量从高温物体传入低温物体; (4) 浓度不等的溶液混合均匀; (5) 锌片与硫酸铜的置换反应等, 它们的逆过程都不能自动进行。当借助外力,体系恢复 原状后,会给环境留下不可磨灭的影响
自发变化的共同特征 自发变化 某种变化有自动发生的趋势,一旦发生就 无需借助外力,可以自动进行,这种变化称为自发变 化。 自发变化的共同特征 —不可逆性 任何自发变化的逆 过程是不能自动进行的。例如: (1) 焦耳热功当量中功自动转变成热; (2) 气体向真空膨胀; (3) 热量从高温物体传入低温物体; (4) 浓度不等的溶液混合均匀; (5) 锌片与硫酸铜的置换反应等, 它们的逆过程都不能自动进行。当借助外力,体系恢复 原状后,会给环境留下不可磨灭的影响

3.1.2热力学第二定律的文字表述 克劳修斯(Clausius)说法: 不可能把热由低温物体传到高温物体,而 不引起其他变化。” 开尔文(Kelvin)说法: 不可能从单一热源取出热使之完全转化为 功,而不发生其它变化。 第二类永动机是不可能的。(从单一热源吸热使 之完全变为功而不留下任何影响。)
3.1.2 热力学第二定律的文字表述 克劳修斯(Clausius)说法: “不可能把热由低温物体传到高温物体,而 不引起其他变化。” 开尔文(Kelvin)说法: “不可能从单一热源取出热使之完全转化为 功,而不发生其它变化。” 第二类永动机是不可能的。(从单一热源吸热使 之完全变为功而不留下任何影响。 )

3.1.3热力学第二定律的数学式表述 热力学第一定律的本质为能量守恒原理:每 一物体都存在一状态函数称为热力学能函数U,在 孤立系统中。不管发生任何变化,各物体的热力 学能总和恒定不变。 ∑B△UB=0 热力学第二定律的本质为熵增加原理:每一 物体都存在一状态函数称为熵S。在孤立系统中, 不管发生任何变化,各物质的熵总和永不降低。 ∑B△SB≥0
3.1.3 热力学第二定律的数学式表述 热力学第一定律的本质为能量守恒原理:每 一物体都存在一状态函数称为热力学能函数U,在 孤立系统中。不管发生任何变化,各物体的热力 学能总和恒定不变。 ∑B △UB=0 热力学第二定律的本质为熵增加原理:每一 物体都存在一状态函数称为熵S 。 在孤立系统中, 不管发生任何变化,各物质的熵总和永不降低。 ∑B△SB≥0

3.2卡诺循环与卡诺定理 3.2.1卡诺循环(Carnot cycle) 高温存储器 1824年,法国工程师 N.L.S.Carnot(1796~1832)设计 了一个循环,以理想气体为 工作物质,从高温(工)热源吸 热机 收Q的热量,一部分通过理 想热机用来对外做功W,另一 部分Q的热量放给低温(T)热 源。这种循环称为卡诺循 低温存储器 环。 卡诺循环
3.2卡诺循环与卡诺定理 3.2.1卡诺循环(Carnot cycle) 1824 年,法国工程师 N.L.S.Carnot (1796~1832)设计 了一个循环,以理想气体为 工作物质,从高温 热源吸 收 的热量,一部分通过理 想热机用来对外做功W,另一 部分 的热量放给低温 热 源。这种循环称为卡诺循 环。 ( ) Th Qh Qc ( ) Tc
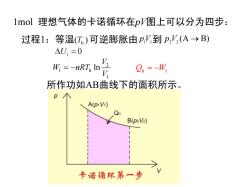
lmol理想气体的卡诺循环在pV图上可以分为四步: 过程1:等温(T)可逆膨胀由p,V到p,'(A→B) △U=0 形=-nRn点 Q.=-W 所作功如AB曲线下的面积所示。 A(piVi) B(p2V2) 卡诺循环第一步
1mol 理想气体的卡诺循环在pV图上可以分为四步: 过程1:等温( ) Th 可逆膨胀由 p1V1到 (A B) p2V2 → 0 ∆U1 = 2 1 h 1 ln V W nRT V = − 所作功如AB曲线下的面积所示。 Q W h 1 = −

过程2:绝热可逆膨胀由p,V,I,到pVT(B→C) 92=0 所=A,=nCrndT 所作功如BC曲线下的面积所示。 A(piVi) B(p2V2) C(paVs) 卡诺循环第二步
过程2:绝热可逆膨胀由 p2 2 V Th到 3 3 c pVT (B → C) 0 Q2 = 所作功如BC曲线下的面积所示。 ∫ = ∆ = ch d 2 2 m TT W U nCV , T

过程3:等温(Tc)可逆压缩由p,',到p'(C→D) △U3=0 W=-nRT。ln Q。=-W 环境对体系所作功如DC曲线下的面积所示 A(piVi) B(pzV2) D(p4Va) C(paVa) 卡诺循环第三步
过程3:等温(TC)可逆压缩由 p3V3 到 (C D) p4V4 → 3 4 3 c 3 0 ln U V W nRT V ∆ = = − 环境对体系所作功如DC曲线下的面积所示 Q W c 3 = −
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第二章 热力学第一定律 The First Law of Thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第一章 绪论 Physical Chemistry.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)14 配合物的电子光谱(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)04 无机碳化学(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)09 热力学研究在无机化学中的应用(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)08 无机高分子(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)07 无机化学中常见图形简介(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)06 无机化学中的耦合现象(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)05 无机化学中的热力学问题(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)03 周期反常现象(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)02 自由能变和标准自由能变(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)29 关于Cu、Ag、Au和Zn、Cd、Hg活泼性的讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)28 对Cu的价态稳定性的热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)27 配合物稳定性的热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)26 自由能-氧化态图及其应用.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)25 过渡系元素的磁性(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)24 离子型化合物的稳定性——大大及小小规则(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)23 电极电势的热力学讨论、氧化还原反应(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)22 电势-pH图及其应用.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)21 元素电势图及其应用.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第五章 化学平衡 Chemical equilibrium.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第四章 多组分系统热力学.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第六章 相平衡.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第七章 电化学.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第九章 统计热力学初步 Foundations of Statistical Thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十一章 化学动力学 chemical kinetics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十二章 胶体系统与粗分散系统 colliod and coarse dispersed system.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十章 界面现象 Interface Phenomenon.pdf
- 暨南大学:《有机化学》课程教学资源(实验指导)有机化学实验指导书PDF电子版(共四十五个实验).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第一章 定量分析概论(主讲:邹明珠、苏星光、赵丽巍).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(1/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(2/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(3/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(1/3).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(2/3).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(3/3).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(4/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(5/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第五章 重量分析法(1/2)§5-1 概述 §5-2 沉淀的溶解度及影响因素 §5-3 沉淀的形成.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第五章 重量分析法(2/2)§5-4 沉淀的纯度 §5-5 沉淀的条件 §5-6 称量形的处理(灼烧)§5-7 有机沉淀剂.pdf
