吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(1/5)

第三章 化学平衡在滴定分析法中的应用 滴定分析法是滴定剂与被测组分反应,按反应类 型分为两大类: 生成反应 沉淀,配合物 转移反应 质子,电子 涉及的平衡问题:滴定曲线,滴定误差,滴定突跃, 可行性判据 §3-1生成反应型的滴定 T+D.K-TD (省去电荷) 滴定剂 被测物 TD K=月 络合滴定 [T][D]= 沉淀滴定 K
第三章 化学平衡在滴定分析法中的应用 化学平衡在滴定分析法中的应用 滴定分析法是滴定剂与被测组分反应,按反应类 型分为两大类: 生成反应 沉淀,配合物 转移反应 质子,电子 涉及的平衡问题:滴定曲线,滴定误差,滴定突跃, 可行性判据 §3-1 生成反应型的滴定 T + D TD (省去电荷) Kt 滴定剂 被测物 沉淀滴定 络合滴定 sp t t 1 1 [T][D] [T][D] [TD] K K K = = = = β

一滴定曲线 pT(或pD)~0(滴定分数)的关系曲线 0= np 滴定剂初始浓度c,加入体积 被测物初始浓度c。,体积o。 通常在理论分析时令c4=c,则0= 滴定至任一点 g92 c40 Cr=V+Vo 1+0 CD= V+Vo 1+0
一 .滴定曲线 pT (或 pD) ~ θ(滴定分数)的关系曲线 D T n n θ = 滴定剂初始浓度 0Tc ,加入体积 V; 被测物初始浓度 0Dc ,体积 V0。 通常在理论分析时令 0 0 D 0 T , V V c = c 则θ = 滴定至任一点 θ θ+ = + = 1 0T 0 0T T c V V c V c +θ = + = 1 0 D 0 0 0 D D c V V c V c

当TD是配合物 er [T]+[TD] cp [D]+[TD] 当TD是沉淀 c=T]+ nTD V+Vo co=[D]+-"D V+Vo 因此cr-co=T]-[D]
当 TD 是配合物 [ ] [ ] [ ] [ ] c D TD c T TD D T = + = + 当 TD 是沉淀 0 0 [ ] [ ] V V n c D V V n c T TD D TD T + = + + = + 因此 c cD [ D T] [ ] T − = −

当0>[T] D1=c-G,=c6-9-80-0 1+0 1+0 当8>1时,T]>D] m=g-cn-0-0-n 1+0 1+0 当0=1时,[T]=[D] 根据平衡常数的关系式,[T]、[D]相互换算, 即可作出pT(pD)~B的曲线
当θ > [T] θ θ θ θ + − = + − = − = 1 (1 ) 1 [D] 0 D 0 T 0 D D T c c c c c 当θ > 1 时,[T] >> [D] θ θ θ θ + − = + − = − = 1 ( 1) 1 [T] 0 T 0 D 0 T T D c c c c c 当θ = 1 时,[T] = [D] 根据平衡常数的关系式, [T]、[D]相互换算, 即可作出 pT (pD) ~ θ 的曲线

(例〉0.1 mol/L AgNO滴定0.1mo/L NaCl,计算0=0.1,0.5, 1,1.5时pAg。 c-0-0 解: 0<1 [CI]= 1+0 0=0.1 [CI]= 0.1X1-0.1) =0.082 1+0.1 [Ag]= K23209 =3.9×09 [ci] 0.082 pAg=8.41 0=05 pAg=8.01 0=1 [Ag"]=[CI ]=Ksp pAg2Pkp2949=474 1 0=1.5 [Ag']= £9-D_01X15-D=0.02 1+0 1+1.5 pAg=1.70
1.70 0.02 1 1.5 0.1 (1.5 1) 1 ( 1) 1.5 [ ] 0 = = + × − = + − = = + + pAg c Ag Ag θ θ θ 〈例〉0.1 mol/L AgNO3滴定0.1 mol/L NaCl,计算θ = 0.1, 0.5, 1, 1.5时pAg。 9.49 4.74 2 1 2 1 1 [ ] [ ] = = × = = = = + − sp sp pAg pK θ Ag Cl K 0.5 8.01 8.41 3.9 10 0.082 3.2 10 [ ] [ ] 0.082 1 0.1 0.1 (1 0.1) 0.1 [ ] 1 (1 ) 1 [ ] 9 10 0 = = = = × × = = = + × − = = + − < = − − − + − − − pAg pAg Cl K Ag Cl c Cl sp Cl θ θ θ θ 解: θ
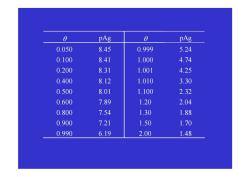
a pAg a pAg 0.050 8.45 0.999 5.24 0.100 8.41 1.000 4.74 0.200 8.31 1.001 4.25 0.400 8.12 1.010 3.30 0.500 8.01 1.100 2.32 0.600 7.89 1.20 2.04 0.800 7.54 1.30 1.88 0.900 7.21 1.50 1.70 0.990 6.19 2.00 1.48
θ pAg θ pAg 0.050 8.45 0.999 5.24 0.100 8.41 1.000 4.74 0.200 8.31 1.001 4.25 0.400 8.12 1.010 3.30 0.500 8.01 1.100 2.32 0.600 7.89 1.20 2.04 0.800 7.54 1.30 1.88 0.900 7.21 1.50 1.70 0.990 6.19 2.00 1.48
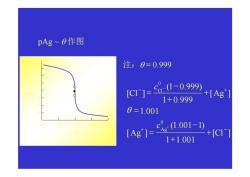
pAg~B作图 注:0=0.999 [C1]= 8-1-0.999 +[Ag] 1+0.999 0=1.001 (Ag'7=101- +[C1j 1+1.001
pAg ~ θ 作图 注:θ = 0.999 1+1.001 [ ] (1.001 1) [ ] 1.001 [ ] 1 0.999 (1 0.999) [ ] 0 0 + − − + + − = = + + − = + − Cl c Ag Ag c Cl Ag Cl θ 0.0 0.5 1.0 1.5 2.0 1 2 3 4 5 6 7 8 9 pAg θ

(例)pH=12,c&。=c=0.02mo/L时Y滴定Ca2, 计算0=0.5,1.0,1.5时的pCa。 解:无副反应,Ca+Y=CaY Ig B=10.7 0=05 Ca”1=80-0-002X0-05=667a0 1+0 1+0.5 pCa=2.18 0=1.0 [Ca2*]=[Y],[CaY]=Cca.eo =0.01 [Ca2] [CaY] 0.01 V100.7 =447107 pCa=6.35 或 ca=gB+0)=07+2)=635
〈例〉pH = 12, 0 0 Ca Y c = c = 0.02 mol/L 时 Y 滴定 Ca2+, 计算θ = 0.5, 1.0, 1.5 时的 pCa。 解:无副反应,Ca + Y CaY lg β = 10.7 (10.7 2) 6.35 21 (lg ) 21 6.35 4.47 10 10 [ ] 0.01 [ ] 1.0 [ ] [ ], [ ] 0.01 2.18 6.67 10 1 0.5 0.02 (1 0.5) 1 (1 ) 0.5 [ ] 7 10.7 2 . 2 3 0 2 = + = + = = = = = × = = = = = = × + × − = + − = = + − + + − pCa pC pCa CaY Ca Ca Y CaY c pCa c Ca eq CaY Ca eq Ca β β θ θ θ θ 或
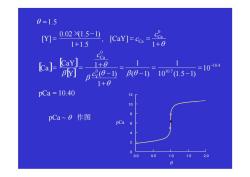
0=1.5 Y]= 0.021.5-) 1+1.5 ICaYl=co0 CCa a]上 CaY] 1+0 BY] Bs0- P0-1)10715-1) =10-104 1+0 pCa=10.40 12 10 pCa~o作图 8 pCa 6 2 0 0.0 0.5 1.0 1.5 2.0 0
[ ] [ ] [ ] 10.40 10 10 (1.5 1) 1 ( 1) 1 1 ( 1) 1 1 , [ ] 1 1.5 0.02 (1.5 1) [ ] 1.5 10.4 0 10.7 0 0 = = − = − = + − + = = + = = + × − = = − pCa c c Y CaY Ca c Y CaY c Y Ca Ca Ca β θ θ θ β θ β θ θ pCa ~ θ 作图 0.0 0.5 1.0 1.5 2.0 0 2 4 6 8 10 12 pCa θ

二.滴定误差与滴定突跃 1.滴定误差:终点与化学计量点不一致所引起的误差 TE=. iVep-CBVo c 分子、分母均除以Vep+o,由于cT=cpW+'p) TE=Cr.ep 二Cp.ep CD.ep 因为CpCp.sp=T]p-[D]p,则 E=2D2 计算误差的出发点 CD.ep
二.滴定误差与滴定突跃 1.滴定误差:终点与化学计量点不一致所引起的误差 0 0 0 0 c V c V c V TE D T ep D o − = 分子、分母均除以 Vep + V0,由于 ( ) 0 0 0 c V cep V Vep = + D ep T ep D ep c c c TE , , , − = 因为 c T ep c D ep T ep D ep [ ] [ ] , , − = − ,则 D ep ep ep c T D TE , [ ] − [ ] = 计算误差的出发点
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第一章 定量分析概论(主讲:邹明珠、苏星光、赵丽巍).pdf
- 暨南大学:《有机化学》课程教学资源(实验指导)有机化学实验指导书PDF电子版(共四十五个实验).pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十章 界面现象 Interface Phenomenon.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十二章 胶体系统与粗分散系统 colliod and coarse dispersed system.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十一章 化学动力学 chemical kinetics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第九章 统计热力学初步 Foundations of Statistical Thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第七章 电化学.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第六章 相平衡.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第四章 多组分系统热力学.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第五章 化学平衡 Chemical equilibrium.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第三章 热力学第二定律 Second law of thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第二章 热力学第一定律 The First Law of Thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第一章 绪论 Physical Chemistry.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)14 配合物的电子光谱(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)04 无机碳化学(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)09 热力学研究在无机化学中的应用(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)08 无机高分子(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)07 无机化学中常见图形简介(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)06 无机化学中的耦合现象(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)05 无机化学中的热力学问题(PPT).ppt
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(2/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(3/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(1/3).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(2/3).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(3/3).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(4/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(5/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第五章 重量分析法(1/2)§5-1 概述 §5-2 沉淀的溶解度及影响因素 §5-3 沉淀的形成.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第五章 重量分析法(2/2)§5-4 沉淀的纯度 §5-5 沉淀的条件 §5-6 称量形的处理(灼烧)§5-7 有机沉淀剂.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第四章 滴定分析法的应用(1/2)§4.1 指示剂.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第四章 滴定分析法的应用(2/2)§4.2 标准溶液的配制和标定 §4.3 应用实例.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第七章 吸光光度法.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第八章 分析实验数据处理.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第六章 分析化学中常用的分离方法(1/3)§6-1 概述 §6-2 沉淀分离法.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第六章 分析化学中常用的分离方法(2/3)§6-3 溶剂萃取分离法.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第六章 分析化学中常用的分离方法(3/3)§6−4 离子交换分离法 §6-5 层析分离法 §6-6 其它分离方法简介.pdf
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第一章 绪论 第一节 概述 generalization.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第一章 绪论 第二节 分类与进展.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第一章 绪论 第三节 课程内容与学习.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第二 章 计算机与仪器分析 第一节 计算机与仪器分析.ppt
