吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(3/3)
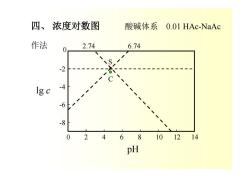
四、浓度对数图 酸碱体系 0.01 HAc-NaAc 作法 2.74 0 6.74 -2 lgc -4 -6 -8 0 2 46810 1214 pH
0 2 4 6 8 10 12 14 -8 -4 0 -6 -2 pH lg c S C 四、 浓度对数图 酸碱体系 0.01 HAc-NaAc 作法 2.74 6.74
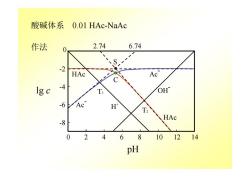
酸碱体系 0.01 HAc-NaAc 作法 2.74 6.74 -2 HAc Ac lg c -4 OH -6 Ac T2 HAc -8 0 2 4 68 101214 pH
Ac - Ac - HAc HAc 0 2 4 6 8 10 12 14 -8 -4 0 -6 -2 S C 2.74 6.74 T2 T1 H+ OH- 酸碱体系 0.01 HAc-NaAc 作法 pH lg c

应用 1)已知某pH值条件下,直接查出各型体的浓度对数值。 c=0.01 mol/L,pH=8 Ig[HAc]=-5.3 1g[Ac]=-2.0 2)估计化学计量点pH值。 T1[Ac]=[H] 强酸滴定Ac计量点(HAc)时质子条件 [H]=[Ac]+[OH] T,[HAc]=[OH] 强碱滴定HAc计量点(Ac)质子条件 [H]+[HAc]=[OH] 多元酸体系点多,直线分段斜率改变。 其他平衡体系浓度对数图
应用 1) 已知某 pH 值条件下,直接查出各型体的浓度对数值。 c = 0.01 mol/L, pH = 8 lg[HAc] = -5.3 lg[Ac-] = -2.0 2) 估计化学计量点 pH 值。 T1 [Ac-] = [H+] 强酸滴定 Ac-计量点(HAc)时质子条件 [H+] = [Ac-] + [OH-] T2 [HAc] = [OH-] 强碱滴定 HAc 计量点(Ac-)质子条件 [H+] + [HAc] = [OH-] 多元酸体系点多,直线分段斜率改变。 其他平衡体系浓度对数图

§2-3 缓冲溶液 定义:对溶液的酸度起稳定作用的溶液。 (1)向溶液中加入少量的强酸或强碱 (2)溶液中的化学反应产生少量的酸或碱 (3)溶液稍加稀释 组成: (1)浓度较大的弱酸及其共轭碱HAC-AC 浓度较大的弱碱及其共轭酸 NH3-NH4*
§2-3 缓冲溶液 定义:对溶液的酸度起稳定作用的溶液。 (1)向溶液中加入少量的强酸或强碱 (2)溶液中的化学反应产生少量的酸或碱 (3)溶液稍加稀释 组成: (1)浓度较大的弱酸及其共轭碱 HAc-Ac- 浓度较大的弱碱及其共轭酸 NH3-NH4+
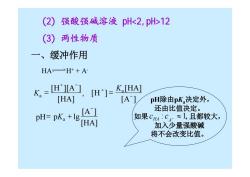
(2) 强酸强碱溶液pH12 (3) 两性物质 一、 缓冲作用 HA-H++A K=[HTA] [H]= K[HA] [HAI [A] pH除由pK决定外, PH=pK,+lg [A 还由比值决定。 如果CHM:C≈1,且都较大, [HA] 加入少量强酸碱 将不会改变比值
pH除由pKa决定外, 还由比值决定。 如果 , 且都较大, 加入少量强酸碱 将不会改变比值。 : − ≈1 HA A c c 一、缓冲作用 [HA] [A ] pH lg [A ] [HA] , [ ] [HA] [H ][A ] − − + + − = + = = a a a pK K K H HA H+ + A- (2) 强酸强碱溶液 pH12 (3) 两性物质
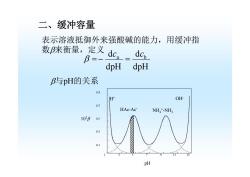
二、缓冲容量 表示溶液抵御外来强酸碱的能力,用缓冲指 数徕衡量,定义dc=dc B=- dpH dpH B与pH的关系 0.9 O旺 01 HAc-Ac NH*-NH; 102B 0.5 0.3 0.1 pH
二、缓冲容量 表示溶液抵御外来强酸碱的能力,用缓冲指 数β来衡量,定义 dpH dc dpH dca b β = − = β与pH的关系 0.9 0.7 0.5 0.3 0.1 1 3 5 7 9 11 13 102β pH HAc-Ac- NH4+-NH3 H+ OH-

什么样的组成B有最大值? 为了简单起见,在cHA中加入Cb, [A]=C [HA]=CHA-Cb 则 pH =pk,+lg-C CHA-Co dpH=d(I)=1 2.303 CHA-C2.303 (d Incp-dIn(CHA-C)) 1 dcs+1 dcs=1.Cna-co t cu dc 2.303G2.303cHA-C2.303,(C-c) B=dc.=23039lGW-G-2303ANIA=23036,6c dpH CHA CHA
什么样的组成 β 有最大值? 为了简单起见,在cHA中加入cb, [A-] = cb [HA] = cHA – cb 则 HA b b a c c c pH pK − = + lg b b HA b HA b b HA b b b b b HA b HA b b dc c c c c c c c c dc c dc d c d c c c c c dpH d 2.303 ( ) 1 2.303 1 2.303 1 ( ln ln( )) 2.303 1 ln ) 2.303 1 ( − − + = ⋅ − = ⋅ + · = − − − = A HA HA HA HA b b HA b c c c c c c dpH dc β 2.303δ δ [A][HA] 2.303 ( ) 2.303 = = − = =

dB d2.3036-0A)c]=0 dδA =0, 有极值, dδA 2.303cHA1-δA)-δA]=0 8=δA=0.5时有极值 即[HA:[A)=1:l,pH=pKa时陌极值。 d6=2308C0-2)<0 d'B 有极大值 A=2303 4 a=0.576Cn CHA=0.01时, Bmax=2.303×0.5×0.5×0.01=0.576×0.01=5.8×10-3mol/L
时有极值 有极值 0.5 2.303 [(1 ) ] 0 0 [2.303 (1 ) ] 0, , = = − − = = − = HA A HA A A A A A HA A c d d c d d δ δ δ δ δ δ δ δ β 即 [HA]:[A] = 1:1, pH=pKa时β有极值。 cHA = 0.01时, 2.303 0.5 0.5 0.01 0.576 0.01 5.8 10 mol/L 3 max − β = × × × = × = × HA HA HA A C C C d d 0.576 4 2.303 2.303 (0 2) 0 max 2 2 = = = − < β δ β 有极大值

1升溶液里可能引入的强酸强碱的量应求积分: Ac,=-ac.=∫mApl 实际计算时 C,=[A]=CHAδA Ka Ka Ac.=CuAC10)
1 升溶液里可能引入的强酸强碱的量应求积分: ∫ ∆ = −∆ = 21 pHpH cb ca βdpH 实际计算时 b HA A c = [A] = c δ ) 10 10 ( HA A HA 2 pH1 a a pH a a b K K K K c c c − − + − + ∆ = ⋅∆δ =

三、缓冲范围 1.一元弱酸及共轭碱 当一种组分是另一种的1/10(既HA][A]为10:1 或1:10)时,缓冲作用已经很小了。 缓冲范围为pK±1个pH单位 2.二元弱酸及共轭碱 当△pKa>2.6时,缓冲范围为两段缓冲溶液 pKal±1;pKa2±1 即HA/HA;HA/A2 当△pK<2.6时,缓冲范围为pKa1-1至pKa2+1
三、缓冲范围 当一种组分是另一种的1/10(既[HA]:[A]为10:1 或1:10)时,缓冲作用已经很小了。 缓冲范围为 pKa + 1 个pH 单位 1. 一元弱酸及共轭碱 2. 二元弱酸及共轭碱 当△ pKa > 2.6时,缓冲范围为两段缓冲溶液 pKa1 + 1 ; pKa2 + 1 即H2A/HA- ; HA- /A2- 当△ pKa < 2.6时,缓冲范围为pKa1 - 1 至pKa2 + 1
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(2/3).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(1/3).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(3/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(2/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(1/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第一章 定量分析概论(主讲:邹明珠、苏星光、赵丽巍).pdf
- 暨南大学:《有机化学》课程教学资源(实验指导)有机化学实验指导书PDF电子版(共四十五个实验).pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十章 界面现象 Interface Phenomenon.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十二章 胶体系统与粗分散系统 colliod and coarse dispersed system.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十一章 化学动力学 chemical kinetics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第九章 统计热力学初步 Foundations of Statistical Thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第七章 电化学.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第六章 相平衡.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第四章 多组分系统热力学.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第五章 化学平衡 Chemical equilibrium.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第三章 热力学第二定律 Second law of thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第二章 热力学第一定律 The First Law of Thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第一章 绪论 Physical Chemistry.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)14 配合物的电子光谱(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)04 无机碳化学(PPT).ppt
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(4/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(5/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第五章 重量分析法(1/2)§5-1 概述 §5-2 沉淀的溶解度及影响因素 §5-3 沉淀的形成.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第五章 重量分析法(2/2)§5-4 沉淀的纯度 §5-5 沉淀的条件 §5-6 称量形的处理(灼烧)§5-7 有机沉淀剂.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第四章 滴定分析法的应用(1/2)§4.1 指示剂.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第四章 滴定分析法的应用(2/2)§4.2 标准溶液的配制和标定 §4.3 应用实例.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第七章 吸光光度法.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第八章 分析实验数据处理.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第六章 分析化学中常用的分离方法(1/3)§6-1 概述 §6-2 沉淀分离法.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第六章 分析化学中常用的分离方法(2/3)§6-3 溶剂萃取分离法.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第六章 分析化学中常用的分离方法(3/3)§6−4 离子交换分离法 §6-5 层析分离法 §6-6 其它分离方法简介.pdf
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第一章 绪论 第一节 概述 generalization.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第一章 绪论 第二节 分类与进展.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第一章 绪论 第三节 课程内容与学习.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第二 章 计算机与仪器分析 第一节 计算机与仪器分析.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第二 章 计算机与仪器分析 第二节 数据采集与计算机控制.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第二 章 计算机与仪器分析 第三节 信息处理与数据挖掘技术.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第二 章 计算机与仪器分析 第四节 人工智能与仿真模拟.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第三章 电化学分析导论 第一节 电化学分析法概述.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第三章 电化学分析导论 第二节 化学电池与电极电位.ppt
