上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第五章 化学平衡 Chemical equilibrium

第五章 化学平衡 Chemical equilibrium 范霍夫平衡箱 dD+eE。=+gG P'D PE P'F P'G
第五章 化学平衡 Chemical equilibrium

5.1化学平衡的条件和反应的亲和势 5.1.1化学反应的方向和限度 在600℃和100kPa下: C.HsC2Hs(g)C.H5C2H3(g)+H2(g) 乙苯的最大转换率不会超过72.8。 5.1.2化学反应的摩尔吉布斯函数变] 设有一任意的封闭系统,无非体积功, dG=-SdT+Vdp+ΣB LB dnB 在定温定压下, dG=∑B UB dnB
5.1 化学平衡的条件和反应的亲和势 5.1.1 化学反应的方向和限度 在600℃和100kPa下: C6H5C2H5 (g) C6H5C2H3 (g)+H2 (g) 乙苯的最大转换率不会超过72.8。 5.1.2 化学反应的摩尔吉布斯函数[变] 设有一任意的封闭系统,无非体积功, dG=-SdT+Vdp+∑B mB dnB 在定温定压下, dG=∑B mB dnB

aA+bByY+zZ 0=yY+zZ-aA-bB 0=∑BBB dξ= dnB 或者 dnB=veds VB dG=∑BBBd5 (yy十4z-a4A-b4B)dξ G def =∑e4=A,Cn亿,p.) T.P 称为化学反应的摩尔吉布斯函数!变引△Gm(molar Gibbs function of chemical reaction) △Gm的SI单位为Jmol-1
aA+bB yY+zZ 0=yY+zZ-aA-bB 0=∑B nB B B d B d n x n = 或者 dnB =nBdx dG=∑B nBmBdx =(ymY+zmZ-amA-bmB)dx n m ( x ) x G T , p, G T ,p B B B r m def = = D ÷ ÷ ø ö ç ç è æ ¶ ¶ å 称为化学反应的摩尔吉布斯函数[变] △rGm (molar Gibbs function of chemical reaction) △rGm的SI单位为J·mol-1

△Gm的物理意义是: 在T、p、时(即在一定的温度、压力和组成的 条件下),把发生d飞的微量反应进度折合成发生单 位反应进度时所引起的系统吉布斯函数变化: 或者在T、p、飞时,含物质的量很大的反应系 统中发生单位反应进度时系统吉布斯函数的变化
△rGm的物理意义是: • 在T、p、x时(即在一定的温度、压力和组成的 条件下),把发生dx 的微量反应进度折合成发生单 位反应进度时所引起的系统吉布斯函数变化; • 或者在T、p、x 时,含物质的量很大的反应系 统中发生单位反应进度时系统吉布斯函数的变化
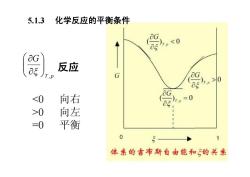
5.1.3 化学反应的平衡条件 OG 5 反应 G .0 0 向左 =0 平衡 0 5 体系的吉布斯自由能和的关系
5.1.3 化学反应的平衡条件 T p G , ÷ ÷ ø ö ç ç è æ ¶ ¶ x 反应 0 向左 =0 平衡

5.1.4化学反应亲和势 l922年,比利时热力学专家德,唐德(De donder)首 先引进了化学反应亲和势的概念。他定义化学亲和势 (affinity of chemical reaction)A为: A 或 A=-△Gm A是状态函数,系统的强度性质。用A判断化学反 应的方向具有势”的性质,即: A>0 反应正向进行 A<0 反应逆向进行 A=0 反应达平衡
5.1.4 化学反应亲和势 1922年,比利时热力学专家德·唐德(De donder)首 先引进了化学反应亲和势的概念。他定义化学亲和势 (affinity of chemical reaction) A为: def , B B B ( )T p G A n m x ¶ - = - ¶ å r m 或 A = -D G A是状态函数,系统的强度性质。用A判断化学反 应的方向具有“势”的性质,即: A>0 反应正向进行 A<0 反应逆向进行 A=0 反应达平衡

5.2化学反应的标准平衡常数 5.2.1理想气体反应的定温方程 0=∑BBB HB(pgm.T,p)=u(g.T)+RTIn 对于理想气体化学反应, △Gm(T,p)=∑BB(g) -m是 =∑8)+∑Rrng
5.2 化学反应的标准平衡常数 5.2.1 理想气体反应的定温方程 0=∑B nB B ( ) ( ) O O B B B pgm, , g, ln p p m T p = m T + RT 对于理想气体化学反应, △rGm(T,p)=∑B nBm B(g) å ( ) ú û ù ê ë é ÷ ÷ ø ö ç ç è æ = + B O O B B B ln p p n m T RT å ( ) å ÷ ÷ ø ö ç ç è æ = + B B O B B O B B ln p p n m T n RT

化学反应的标准摩尔吉布斯函数I变!△,G9(standard molar Gibbs function of chemical reaction) def A.GT)∑BgT) △,G8仅仅是温度的函数,它的SI单位为Jmol-1。 理想气体反应的定温方程 △,G(亿,p)=A,G(T)+RI∑BIm =Acg)TnΠ.g 分压商-Π O是一个量纲一的量,SI单位为1
化学反应的标准摩尔吉布斯函数[变] (standard molar Gibbs function of chemical reaction) O DrGm D G ( ) T = å ( ) T B O B B O r m def n m 仅仅是温度的函数,它的SI单位为J·mol-1 。 O DrGm 理想气体反应的定温方程 ( ) ( ) å ÷ ÷ ø ö ç ç è æ D = D + B O O B r m r m B , ln n p p G T p G T RT ( ) Õ ÷ ÷ ø ö ç ç è æ = D + B O O B r m B ln n p p G T RT 分压商 Õ ÷ ÷ ø ö ç ç è æ = B O O B n B p p J Jy是一个量纲一的量,SI单位为1

分压商 △,Gm(T,p)=△,Ge(T)+R7TnJe 理想气体反应的定温方程
分压商 a b y z p p p p p p p p J ÷ ÷ ø ö ç ç è æ ÷ ÷ ø ö ç ç è æ ÷ ÷ ø ö ç ç è æ ÷ ÷ ø ö ç ç è æ = y y y y y A B Y Z ( ) ( ) y y G T , p G T RTlnJ Dr m = Dr m + 理想气体反应的定温方程

5.2.2理想气体反应的标准平衡常数 0=∑BBB 化学反应的平衡条件为: △Gm=∑BB43(T,p,ξeq)=0 A.Ge(T)=-RTInΠB 化学反应的标准平衡常数Ke(standard equilibrium constant)) def A.GR(T)=EBv uT)-RTIn ke(T) 6e2' RT A,G(T)=-RTInKo(T)
5.2.2 理想气体反应的标准平衡常数 0=∑B nB B 化学反应的平衡条件为: △rGm=∑B nBmB(T,p,x eq)=0 ( ) Õ ÷ ÷ ø ö ç ç è æ D = - B O eq O B r m B ln n p p G T RT G ( ) T ( ) T RT K ( ) T O B O B B O r m ln def D = å n m = - ( ) ( ) ú ú û ù ê ê ë é = - å RT T K T B O O B B exp def n m G (T ) RT K (T ) O O r m D = - ln 化学反应的标准平衡常数Ky(standard equilibrium constant)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第三章 热力学第二定律 Second law of thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第二章 热力学第一定律 The First Law of Thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第一章 绪论 Physical Chemistry.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)14 配合物的电子光谱(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)04 无机碳化学(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)09 热力学研究在无机化学中的应用(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)08 无机高分子(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)07 无机化学中常见图形简介(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)06 无机化学中的耦合现象(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)05 无机化学中的热力学问题(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)03 周期反常现象(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)02 自由能变和标准自由能变(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)29 关于Cu、Ag、Au和Zn、Cd、Hg活泼性的讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)28 对Cu的价态稳定性的热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)27 配合物稳定性的热力学讨论(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)26 自由能-氧化态图及其应用.pdf
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)25 过渡系元素的磁性(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)24 离子型化合物的稳定性——大大及小小规则(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)23 电极电势的热力学讨论、氧化还原反应(PPT).ppt
- 西北大学:《中级无机化学》课程教学课件(专题讲稿)22 电势-pH图及其应用.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第四章 多组分系统热力学.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第六章 相平衡.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第七章 电化学.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第九章 统计热力学初步 Foundations of Statistical Thermodynamics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十一章 化学动力学 chemical kinetics.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十二章 胶体系统与粗分散系统 colliod and coarse dispersed system.pdf
- 上海应用技术大学(上海应用技术学院):《物理化学》课程教学课件(讲稿)第十章 界面现象 Interface Phenomenon.pdf
- 暨南大学:《有机化学》课程教学资源(实验指导)有机化学实验指导书PDF电子版(共四十五个实验).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第一章 定量分析概论(主讲:邹明珠、苏星光、赵丽巍).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(1/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(2/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(3/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(1/3).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(2/3).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第二章 分析化学中的化学平衡(3/3).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(4/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第三章 滴定分析法(5/5).pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第五章 重量分析法(1/2)§5-1 概述 §5-2 沉淀的溶解度及影响因素 §5-3 沉淀的形成.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第五章 重量分析法(2/2)§5-4 沉淀的纯度 §5-5 沉淀的条件 §5-6 称量形的处理(灼烧)§5-7 有机沉淀剂.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第四章 滴定分析法的应用(1/2)§4.1 指示剂.pdf
