桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第七章 化学平衡

第七章 化学平衡 7.1化学反应的可逆性和化学平衡 7.2 平衡常数 7.3平衡常数与Gibbs自由能变 7.4化学平衡的移动
第七章 化学平衡 7.2 平衡常数 7.3 平衡常数与Gibbs自由能变 7.4 化学平衡的移动 7.1 化学反应的可逆性和化学平衡

7.1化学反应的可逆性和化学平衡 Fe203(s)+3c0(g)=2Fe(s)+3c02(g) 炼一吨Fe需多少焦炭(C)? C(s)+0.5.02(g)=C0(g) 是否全部的c(s)能转化成Co(g),全部的Fe203(s)和C0 能全部转化成Fe(s)和c02(g)? 答案:否! ·可逆反应,动态平衡(△G=0) 正向反应速率=逆向反应速率 ·平衡常数以及平衡的移动 无机化学
无机化学 7.1 化学反应的可逆性和化学平衡 Fe2O3(s) + 3 CO(g) = 2 Fe(s) + 3 CO2(g) 炼一吨 Fe 需多少焦炭(C)? C(s) + 0.5 O2(g) = CO(g) 是否全部的C(s) 能转化成CO(g),全部的Fe2O3(s) 和CO 能全部转化成Fe(s) 和 CO2(g)? 答案:否! • 可逆反应,动态平衡(G = 0) 正向反应速率 = 逆向反应速率 • 平衡常数以及平衡的移动
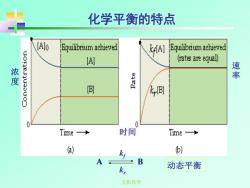
化学平衡的特点 Equilbrium achieved kA] Equilibrium achieved (A] ates are equa) 澄 3E 辈 k 0 Time 时间 Time ) ) A B 动态平衡 无机化学
无机化学 化学平衡的特点 动态平衡 浓 度 速 率 时间 A B kf kr

7.2平衡常数 一、经验平衡常数 可逆反应:aA+bB=cC+dD 若均为气体,且在温度为T(K时达到平衡: [Pcl.[PpJ -Kp [PAI[PBJ 其中,PJ等为平衡分压,Kp为压力平衡常数 若在溶液中,平衡时的浓度分别为A]., CI·D =KCKc为浓度平衡常数 [Aa·Bb 兼Kp、Kc可由实验测定,称之为经验平衡常数 无机化学
无机化学 7.2 平衡常数 可逆反应:aA + bB = cC + dD 若均为气体,且在温度为 T (K) 时达到平衡: 一、经验平衡常数 Kp [P ] [P ] [P ] [P ] b B a A d D c C = 其中,[PA] 等为平衡分压,Kp 为压力平衡常数 若在溶液中,平衡时的浓度分别为[A] , Kc [A] [B] [C] [D] a b c d = Kc 为浓度平衡常数 Kp、Kc 可由实验测定,称之为经验平衡常数
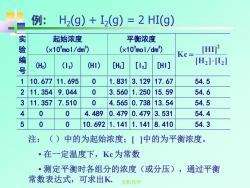
例:H2(g)+I2(g)=2HI(g) 实 起始浓度 平衡浓度 验 (x10mol/dm) (x10mol/dm) Kc= [Hn2 编 号 (H2) (12) (HI) [H2] [l2] CHI] [H22] 1 10.677 11.695 0 1.831 3.129 17.67 54.5 2 11.354 9.044 0 3.560 1.250 15.59 54.6 3 11.357 7.510 0 4.5650.738 13.54 54.5 4 0 0 4.489 0.4790.479 3.531 54.4 5 0 0 10.6921.1411.1418.410 54.3 注:()中的为起始浓度;「1中的为平衡浓度。 ·在一定温度下,Kc为常数 ·测定平衡时各组分的浓度(或分压),通过平衡 常数表达式,可求出K 无机化学
无机化学 例: H2 (g) + I2 (g) = 2 HI(g) 起始浓度 (103 mol/dm3 ) 平衡浓度 (103 mol/dm3 ) 实 验 编 号 (H2) (I2) (HI) [H2] [I2] [HI] [H ] [I ] [HI] K c 2 2 2 = 1 10.677 11.695 0 1.831 3.129 17.67 54.5 2 11.354 9.044 0 3.560 1.250 15.59 54.6 3 11.357 7.510 0 4.565 0.738 13.54 54.5 4 0 0 4.489 0.479 0.479 3.531 54.4 5 0 0 10.692 1.141 1.141 8.410 54.3 注:( )中的为起始浓度;[ ]中的为平衡浓度。 • 在一定温度下,Kc 为常数 • 测定平衡时各组分的浓度(或分压),通过平衡 常数表达式,可求出K
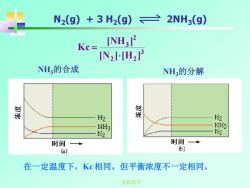
N2(g)+3H2(g)≥ 2NH3(g) Kc= [NH3P2 [N2H23 NH3的合成 NH3的分解 鬟 翼 H2 H2 NH3 g N2 N2 时间 时间 (a) b】 在一定温度下,Kc相同,但平衡浓度不一定相同。 无机化学
无机化学 N2(g) + 3 H2(g) 2NH3(g) 3 2 2 2 3 [N ] [H ] [NH ] Kc = NH3的合成 NH3的分解 在一定温度下,Kc 相同,但平衡浓度不一定相同

二、平衡转化率 化学反应达到平衡状态时,体系中各物质的浓 度不再随时间而改变,这时反应物已最大限度 地转变为生成物。 ■利用平衡转化率来标志化学反应在某个具体条 件下的完成程度。 反应的转化率是指已转化为生成物的部分占该 反应物起始总量的百分比。 无机化学
无机化学 二、平衡转化率 ◼ 化学反应达到平衡状态时,体系中各物质的浓 度不再随时间而改变,这时反应物已最大限度 地转变为生成物。 ◼ 利用平衡转化率来标志化学反应在某个具体条 件下的完成程度。 ◼ 反应的转化率是指已转化为生成物的部分占该 反应物起始总量的百分比

三、标准平衡常数 (K0) h p ■在液相反应中把平衡浓度除以标准状态下浓度;在气 相反应中把平衡分压除以标准压强;使计算出的标准 平衡常数为一无量纲的常数。 ■在液相反应的K与K在数值上相等,而在气相反应的 K,一般不与其K的数值相等。 无机化学
无机化学 三、标准平衡常数(K ) ◼ 在液相反应中把平衡浓度除以标准状态下浓度;在气 相反应中把平衡分压除以标准压强;使计算出的标准 平衡常数为一无量纲的常数。 ◼ 在液相反应的Kc与Kθ 在数值上相等,而在气相反应的 Kp一般不与其Kθ 的数值相等。 b B a A h H g G a b g h p p p p p p p p c B c A c H c G K = = [ ] [ ] [ ] [ ]
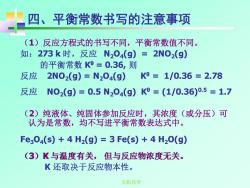
四、平衡常数书写的注意事项 (1)反应方程式的书写不同,平衡常数值不同。 如: 273k时,反应N204(g)=2N02(g) 的平衡常数K0=0.36,则 反应 2NO2(g)=N204(g) K9=1/0.36=2.78 反应 N02(g)=0.5N204(g)K0=(1/0.36)0.5=1.7 (2)纯液体、纯固体参加反应时,其浓度(或分压)可 认为是常数,均不写进平衡常数表达式中。 Fe304(s)+4H2(g)=3Fe(s)+4H20(g) (3)K与温度有关,但与反应物浓度无关。 K还取决于反应物本性。 无机化学
无机化学 四、平衡常数书写的注意事项 (1)反应方程式的书写不同,平衡常数值不同。 如:273 k 时,反应 N2O4(g) = 2NO2(g) 的平衡常数 Kθ = 0.36, 则 反应 2NO2(g) = N2O4(g) Kθ = 1/0.36 = 2.78 反应 NO2(g) = 0.5 N2O4(g) Kθ = (1/0.36)0.5 = 1.7 (2)纯液体、纯固体参加反应时,其浓度(或分压)可 认为是常数,均不写进平衡常数表达式中。 Fe3O4(s) + 4 H2(g) = 3 Fe(s) + 4 H2O(g) (3)K 与温度有关, 但与反应物浓度无关。 K 还取决于反应物本性

五、化学反应的限度与平衡常数K K反映了在给定温度下,反应的限度。 K值大,反应容易进行。 一般认为, (1)K≥10+7 自发,反应彻底 (2)K≤10-7 非自发,不能进行 (3)10+7≥K≥10-7 一定程度进行 反应程度受浓度、压力、等条件的影响。可通过实验条 件促进平衡的移动。 怎样求K? (1)测定 (2)热力学计算 无机化学
无机化学 五、化学反应的限度与平衡常数K K 反映了在给定温度下,反应的限度。 K值大,反应容易进行。 一般认为, (1) K 10+7 自发,反应彻底 (2) K 10 -7 非自发,不能进行 (3) 10+7 K 10 -7 一定程度进行 反应程度受浓度、压力、等条件的影响。可通过实验条 件促进平衡的移动。 怎样求K? (1)测定 (2)热力学计算
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第六章 化学反应速率.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第五章 化学热力学初步.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第四章 化学键与分子结构.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第三章 原子结构.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第二章 物质的状态.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第一章 绪论(主讲:莫德清).ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第八章 生物化学过程的调控.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第七章 生物氧化.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第六章 核酸 Nucleic Acid.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第五章 酶化学 Enzyme.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第四章 聚糖的化学.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第三章 蛋白质 Protein.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第二章 生物膜 biological membrane.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第一章 生命 Biochemistr(主讲教师:马林).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §5 溶胶的电学性质.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §4 溶胶的光学性质.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §3 溶胶的动力性质.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §2 溶胶的制备与净化.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(7/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(6/7).ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第八章 溶液.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第九章 电解质溶液.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十一章 P区元素.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十二章 S区元素.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十三章 配位化合物.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十四章 过渡元素 ⅣB-ⅦB Ⅷ.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十章 遗传信息的传递和表达.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十一章 基因表达调控(Control of Gene Expression).ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第二章 蛋白质.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第三章 酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第四章 维生素与辅酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第五章 生物氧化.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第七章 脂类代谢 Metabolism of Lipid.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第九章 核酸的化学.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第二章 化学热力学基础.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第三章 化学平衡.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第四章 化学反应速率.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第五章 酸碱解离平衡.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第六章 难溶强电解质的沉淀-溶解平衡.ppt
