桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第三章 原子结构

第三章 原子结构 3.1核外电子的运动状态 3.2核外电子的排布和元素周期系
第三章 原子结构 3.1 核外电子的运动状态 3.2 核外电子的排布和元素周期系

3.1核外电子的运动状态 氢原子光谱与Bohr模型 H 400TT450TT500T550600TT650700nm 无机化学
无机化学 3.1 核外电子的运动状态 一、氢原子光谱与Bohr模型

实验规律(Balmer,Rydberg) 波数=1/入 =RH×(1/22-1/n2) n=3,4,5,.) Ru=Rydberg常数,为1.0967758×107(m) 无机化学
无机化学 实验规律 (Balmer, Rydberg) 波数 = 1/ = RH (1 / 2 2 – 1/ n 2 ) (n = 3, 4, 5,.) RH = Rydberg 常数,为1.0967758 107 (m-1 )
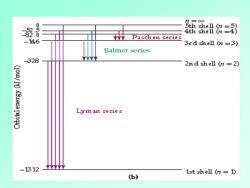
72=00 0 盘盅盘粉二 -146 Paschen serie三 3rd shell (n=3) Balmer series 328 2nd sh ell =2) Lyman serie s -1312 1sts1e12=1) (b)

Bohr 模型: 量子化概念 △E=hv=hc/入 波数=△E/hc)=B/hc)×(11n2-1/n,) 其中,B/hc)=1.0973731×107(m-)与 Ru很相近。 (原子有确定的电子轨道,轨道能量是量子化 的,电子跃迁吸收或发射能量) 无机化学
无机化学 Bohr 模型: E = h =hc/ 波数= E/(hc )= B/(hc) (1 / n1 2 – 1/ n2 2 ) 其中, B/(hc) = 1.0973731 107 (m-1 ) 与 RH很相近。 (原子有确定的电子轨道,轨道能量是量子化 的,电子跃迁吸收或发射能量) e 量子化概念

Bohr模型的局限性: ■对多原子体系不适用,也不能解释 光谱的精细结构,等等。 ·没有正确描述电子的微观状态。 无机化学
无机化学 Bohr模型的局限性: ◼ 对多原子体系不适用,也不能解释 光谱的精细结构,等等。 ◼ 没有正确描述电子的微观状态

二、微观粒子的运动规律 1、波粒二象性 1924,法国Louis de Broglie 能量E=hv 动量P=h/? E,P 粒性 V,入波性 De Broglie关系入=h/P=h/(mv) 无机化学
无机化学 1、波粒二象性 1924,法国Louis de Broglie 能量 E = h 动量 P = h/ E, P 粒性 , 波性 De Broglie关系 = h / P = h / (mv) 二、微观粒子的运动规律

[例] 子弹,m=2.5×102Kg,v=300ms-; 电子,m。=9.1×1031Kg,v=5.9×105ms 波长: 子弹入=h/(mw)=6.6×10-34/(2.5×10-2×300) =8.8×1035(m)可忽略,主要表现为粒性。 电子入=h/(mv) =6.6×10-34/(9.1×10-31×5.9×10-5) =12×1010(m)=1.2nm
[例] 子弹,m = 2.5 × 10-2 Kg, v = 300 ms-1 ; 电子,me = 9.1×10-31Kg, v = 5.9×10-5 ms-1 ; 波长: 子弹 = h / (mv) = 6.6×10-34 / (2.5 × 10-2 300) = 8.8 10-35 (m) 可忽略,主要表现为粒性。 电子 = h / (mv) = 6.6×10-34 / (9.1 × 10-31 5.9×10-5 ) = 12 10-10 (m) = 1.2 nm

电子衍射 1927,美国C.Davisson and L.Germar “几率波” 无机化学
无机化学 电子衍射 1927, 美国 C. Davisson and L. Germar “几率波

2、波函数(w)和Schr6 dinger方程 1926年,奥地利Schrodinger Schrodinger方程(对于单电子体系): a2wlox2+a2y/ay2+a2y/62+8π2m/h2(E-V)Ψ=0 其中,波函数y,反映了电子的波性; m,E,V,等反映了电子的粒性。 无机化学
无机化学 2、波函数()和 Schrődinger方程 1926年,奥地利 Schrődinger Schrődinger 方程(对于单电子体系): 2/x 2+ 2/y 2+ 2/z 2 + 8 2m/h2 (E-V) = 0 其中,波函数,反映了电子的波性; m,E,V,等反映了电子的粒性
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第二章 物质的状态.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第一章 绪论(主讲:莫德清).ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第八章 生物化学过程的调控.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第七章 生物氧化.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第六章 核酸 Nucleic Acid.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第五章 酶化学 Enzyme.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第四章 聚糖的化学.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第三章 蛋白质 Protein.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第二章 生物膜 biological membrane.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第一章 生命 Biochemistr(主讲教师:马林).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §5 溶胶的电学性质.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §4 溶胶的光学性质.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §3 溶胶的动力性质.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §2 溶胶的制备与净化.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(7/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(6/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(5/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(4/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(3/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(1/7).ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第四章 化学键与分子结构.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第五章 化学热力学初步.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第六章 化学反应速率.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第七章 化学平衡.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第八章 溶液.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第九章 电解质溶液.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十一章 P区元素.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十二章 S区元素.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十三章 配位化合物.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十四章 过渡元素 ⅣB-ⅦB Ⅷ.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十章 遗传信息的传递和表达.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十一章 基因表达调控(Control of Gene Expression).ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第二章 蛋白质.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第三章 酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第四章 维生素与辅酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第五章 生物氧化.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第七章 脂类代谢 Metabolism of Lipid.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第九章 核酸的化学.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第二章 化学热力学基础.ppt
