桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第五章 化学热力学初步

第五章化学热力学初步 5.1热力学第一定律 ■5.2热化学 ■5.3化学反应方向
第五章 化学热力学初步 ◼ 5.1 热力学第一定律 ◼ 5.2 热化学 ◼ 5.3 化学反应方向
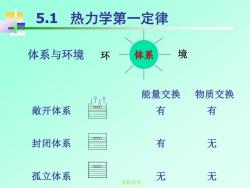
5.1热力学第一定律 体系与环境 环 体系 境 能量交换 物质交换 敞开体系 有 有 封闭体系 有 无 孤立体系 无 无 无机化学
无机化学 5.1 热力学第一定律 体系与环境 能量交换 物质交换 敞开体系 有 有 封闭体系 有 无 孤立体系 无 无 环 体系 境

一、化学热力学的常用术语1 ■状态和状态函数: 状态由一些物理量来确定,如气体的状态由P、V、 T、n等来确定。 决定体系状态的物理量称为状态函数。P、V、T、 n等均是状态函数。 ■途径和过程: 状态发生变化的经过称过程。 完成这个过程的具体步骤称途径。 等温过程:反应前后温度不变(△T=0) 等压过程:反应前后压力不变(△P=0) 等容过程:反应前后体积不变(△V=0) 绝热过程:反应中体系与环境无热量交换(Q=O) 无机化
无机化学 一、化学热力学的常用术语1 ◼ 状态和状态函数: 状态由一些物理量来确定,如气体的状态由P、V、 T、n 等来确定。 决定体系状态的物理量称为 状态函数。 P、V、T、 n 等均是状态函数。 ◼ 途径和过程: 状态发生变化的经过 称过程。 完成这个过程的具体步骤称途径。 等温过程:反应前后温度不变 ( T = 0) 等压过程:反应前后压力不变 ( P = 0) 等容过程:反应前后体积不变 ( V = 0) 绝热过程:反应中体系与环境无热量交换 ( Q = 0)

化学热力学的常用术语2 热和功(没有过程就没有热和功) 体系与环境之间因温度不同而交换或传递的能量称为热 (Q)。 Q>0,体系吸收热量 QO,体系对环境做功 W<O,环境对体系做功 内能:体系内部储存的总能量称为内能(U)。U为状态函 数。体系内能的绝对值至今尚无法知道。 无机化学
无机化学 化学热力学的常用术语2 ◼ 热和功(没有过程就没有热和功) 体系与环境之间因温度不同而交换或传递的能量称为热 (Q)。 Q>0, 体系吸收热量 Q0, 体系对环境做功 W<0, 环境对体系做功 ◼ 内能:体系内部储存的总能量称为内能(U)。U 为状态函 数。体系内能的绝对值至今尚无法知道

二二、热力学第一定律 △U=Q-W(封闭体系) △U:体系内能的改变; Q:体系吸的热: W:体系对环境所做的功,可以是机械功、电功、 体积膨胀功等。 无机化学
无机化学 二、热力学第一定律 U = Q – W (封闭体系) U: 体系内能的改变; Q:体系吸的热; W: 体系对环境所做的功,可以是机械功、电功、 体积膨胀功等
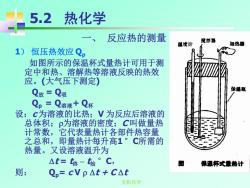
5.2 热化学 反应热的测量 搅拌器 湛度让 加热器 1) 恒压热效应Qp 如图所示的保温杯式量热计可用于测 定中和热、溶解热等溶液反映的热效 应。(大气压下测定) Q放=Q吸 Qp=Q溶液十Q标 设:c为溶液的比热;V为反应后溶液的 总体积;p为溶液的密度;,C叫做量热 计常数,它代表量热计各部件热容量 之总和,即量热计每升高1°C所需的 热量。又设溶液温升为 △t=终-始°C, 保通杯式量热计 则: Qp=cVp△t+CAt 无机化学
无机化学 5.2 热化学 1) 恒压热效应 Qp 如图所示的保温杯式量热计可用于测 定中和热、溶解热等溶液反映的热效 应。(大气压下测定) Q放 = Q吸 Qp = Q溶液+ Q杯 设:c 为溶液的比热;V 为反应后溶液的 总体积;为溶液的密度;C 叫做量热 计常数,它代表量热计各部件热容量 之总和,即量热计每升高1 °C所需的 热量。又设溶液温升为 t = t终 – t始 °C, 则: Qp= c V t + C t 一、 反应热的测量

2)1 恒容热效应Qy 如图所示的弹式量热计可用于 弹式量热计 测定燃烧热。 Q放=Q吸 Qv=Q水+Q弹 设:水浴中水量为mg)水 的比热是4.18·g 1·9 1, 温升为△t。C,则: Q水=4.18×m×△t Q弹=CX△t C是量热计常数,可由标准物 质(如苯甲酸)进行标定。 绝热外套 钢弹(氧弹) 无机化学
无机化学 2) 恒容热效应 Qv 如图所示的弹式量热计可用于 测定燃烧热。 Q放 = Q吸 Qv = Q水+ Q弹 设:水浴中水量为 m (g), 水 的比热是4.18 J ·g-1 ·°C-1 , 温升为 t °C,则: Q水=4.18 × m × t Q弹= C × t C 是量热计常数,可由标准物 质(如苯甲酸)进行标定。 绝热外套 钢弹(氧弹) 弹式量热计

二、焓(H)与焓变(△H)(Enthalpy) 在恒压条件下,只做体积功时,W=P△V, 则有: AU=Qp-PAV 或 Qp=△U+P△V =(U2U1)+PV2V) =(U2+PV2)-(U1+PV1) 定义:H=U+PV(焓的定义) 得:Qp=H2-H1=△H 即:△H=Qp(在数值上) (封闭体系、等压过程、只做体积功) 无机化学
无机化学 二、 焓(H)与焓变(H) (Enthalpy) ◼ 在恒压条件下,只做体积功时,W = P V, 则有: U = Qp – P V 或 Qp = U + P V = (U2 –U1) + P(V2 –V1) = (U2 + PV2) – (U1 + PV1) ◼ 定义:H U + PV (焓的定义) 得:Qp = H2 – H1 = H 即:H = Qp (在数值上) (封闭体系、等压过程、只做体积功)

焓与焓变 ■△H,H为状态函数。 △H反映了化学反应的热效应。 △H为广度量(容量性质),即与物质的量有关系的量。 (强度量:与物质的量无关系的量,无加合性。如温度) ■在恒容条件下,△V=0,体系不做体积功(也不 做其它功),即W=O, 此时,热力学第一定律可表示为: △U=Qy 在此条件下,体系吸收的热量,只用于改变内能。 无机化学
无机化学 焓与焓变 ◼ H,H 为状态函数。 H 反映了化学反应的热效应。 H 为广度量(容量性质),即与物质的量有关系的量。 (强度量:与物质的量无关系的量,无加合性。如温度) ◼ 在恒容条件下, V = 0, 体系不做体积功(也不 做其它功), 即 W = 0, 此时,热力学第一定律可表示为: U = QV 在此条件下,体系吸收的热量,只用于改变内能

三、利用焓变计算内能改变量 ■在101.3kPa和100°C条件下,反应: H2(g)+02(g)=H20(g) 的△H=-241.8kJ/mol,求△U. ■解:△U=△H-P△V 恒温、恒压过程,PAV=△ngRT △ng为产物和反应物气体的量之差。 △U=AH-△ngRT =-241.8-[(1-1.5)×8.31×10-3×373] =-241.8-(-1.50)=-240(kJ/mol) ■可以看出,△n。RT项相对于△H项数值小得多,一般来 说可以用△H来近似估算AU。(Qp≈Qv) 无机化学
无机化学 三、利用焓变计算内能改变量 ◼ 在101.3 kPa 和100 °C 条件下,反应: H2(g) + O2(g) = H2O(g) 的 H = -241.8 kJ/mol, 求U. ◼ 解:U = H – PV 恒温、恒压过程, PV = ng RT ng 为产物和反应物气体的量之差。 U = H – ng RT = -241.8 –[(1 –1.5)×8.31 ×10-3 ×373] = -241.8 – (-1.50) = -240 (kJ/mol) ◼ 可以看出, ng RT项相对于H 项数值小得多,一般来 说可以用H 来近似估算U。(Qp Qv)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第四章 化学键与分子结构.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第三章 原子结构.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第二章 物质的状态.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第一章 绪论(主讲:莫德清).ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第八章 生物化学过程的调控.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第七章 生物氧化.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第六章 核酸 Nucleic Acid.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第五章 酶化学 Enzyme.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第四章 聚糖的化学.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第三章 蛋白质 Protein.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第二章 生物膜 biological membrane.ppt
- 华南农业大学:《生物化学》课程教学资源(PPT课件)第一章 生命 Biochemistr(主讲教师:马林).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §5 溶胶的电学性质.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §4 溶胶的光学性质.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §3 溶胶的动力性质.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §2 溶胶的制备与净化.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(7/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(6/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(5/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(4/7).ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第六章 化学反应速率.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第七章 化学平衡.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第八章 溶液.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第九章 电解质溶液.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十一章 P区元素.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十二章 S区元素.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十三章 配位化合物.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十四章 过渡元素 ⅣB-ⅦB Ⅷ.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十章 遗传信息的传递和表达.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十一章 基因表达调控(Control of Gene Expression).ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第二章 蛋白质.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第三章 酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第四章 维生素与辅酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第五章 生物氧化.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第七章 脂类代谢 Metabolism of Lipid.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第九章 核酸的化学.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第二章 化学热力学基础.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第三章 化学平衡.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第四章 化学反应速率.ppt
