哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第四章 化学反应速率

第四章 化学反应速率 第一节 化学反应速率及其表示方法 第二节 反应速率理论简介 第三节 浓度对化学反应速率的影向 第四节 温度对化学反应速率的影响 第五节 催化剂对化学反应速率的影响
第一节 化学反应速率及其表示方法 第二节 反应速率理论简介 第三节 浓度对化学反应速率的影响 第四节 温度对化学反应速率的影响 第五节 催化剂对化学反应速率的影响 第四章 化学反应速率

第一节化学反应速率及其表示方法 一、转化速率 二、反应速率 三、消耗速率和生成速率
第一节 化学反应速率及其表示方法 一、转化速率 二、反应速率 三、消耗速率和生成速率

一、转化速率 对化学反应0=∑B,转化速率定义为: B def ds 1 dnB 款育科学 十五” dt期划gdt成果 转化速率与B的选择无关,但与化学反应 方程式的写法有关。 无机化学 (供药学类及医学检验专业用
一、转化速率 对化学反应 , 转化速率定义为: 转化速率与 B 的选择无关,但与化学反应 方程式的写法有关。 def B B d 1 d d d n t v t = . B B 0 B = v

二、反应速率 对等容反应,反应速率定义为: def =1d(n/= 1 dcB dt 研究成果'B dt 对溶液中发生的化学反应: aA(aq)+bB(aq)->yY(aq)+zZ(aq) 反应速率可表示为: v=1 deA= 1 den1 dey=1 dez a dt b dty dt zdt 对气相反应,常用气体的分压力代替浓度: D 1.dpn (供药学类及学d专业用
二、反应速率 对气相反应,常用气体的分压力代替浓度: 对等容反应,反应速率定义为: B B B B def 1 1 d( / ) d d d n V c V v t v t v = = a b y z A(aq) B(aq) Y(aq) Z(aq) + ⎯⎯→ + 1 d 1 d 1 d 1 d A B Y Z = = = d d d d c c c c a t b t y t z t v = − − B B 1 d d p v t v = 对溶液中发生的化学反应: 反应速率可表示为:

三、消耗速率和生成速率 消耗速率定义为反应物A的浓度随时间的 变化率: def 款育科学 A五”国家dt 课晒研究成果 生成速率定义为产物Z的浓度随时间的变 化率: at. dcz t 反应速率、 消耗速率与生成速率的关系为: v- A∠Vz V%。 (供药学类及医学检验专业用)
三、消耗速率和生成速率 消耗速率定义为反应物A 的浓度随时间的 变化率: 生成速率定义为产物 Z 的浓度随时间的变 化率: 反应速率、消耗速率与生成速率的关系为: d A d c t v − def A Z A Z v v = − = v v v Z Z d d c t v def A

第二节、反应速率理论 一、碰撞理论 二、过渡状态理论
第二节 反应速率理论 一、碰撞理论 二、过渡状态理论

一、 碰撞理论 碰撞理论认为:化学反应的实质是原子的 重新组合,在组合过程中,必须破坏反应物分 子中的化学键,才能形成产物分子中的化学键。 而旧化学键的断裂和新化学键的形成,是通过 反应物分子间的碰撞实现的。在反应物分子的 无数次碰撞中,只有极少数的碰撞能发生化学 反应。这种能发生化学反应的碰撞称为有效碰 撞。能发生有效碰撞的分子称为活化分子,它 比普通分子具有更高的能量。 通常把活化分子具有的平均能量与反应物 分子的平均能量之差称为反应的活化能。 (供药学类及医学检验专业用】
一、碰撞理论 碰撞理论认为:化学反应的实质是原子的 重新组合,在组合过程中,必须破坏反应物分 子中的化学键,才能形成产物分子中的化学键。 而旧化学键的断裂和新化学键的形成,是通过 反应物分子间的碰撞实现的。在反应物分子的 无数次碰撞中,只有极少数的碰撞能发生化学 反应。这种能发生化学反应的碰撞称为有效碰 撞。能发生有效碰撞的分子称为活化分子,它 比普通分子具有更高的能量。 通常把活化分子具有的平均能量与反应物 分子的平均能量之差称为反应的活化能
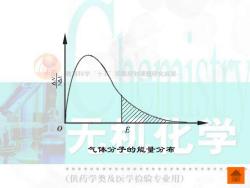
款看科学十入国家规划课晒研究成果 气体分子的能量分布 (供药学类及医学检验专业用)
气体分子的能量分布 E

在一定温度下,反应的活化能越大,活化 分子越少,有效碰撞次数就越少,化学反应速 率就越慢;反应的活化能越小,活化分子越多 有效碰撞次数就越多,化学反应速率就越快。 除了要考虑反应物分子间的碰撞频率和反 应物的活化能外,还要考虑碰撞时分子的空间 取向。活化分子要发生有效碰撞,它们彼此间 机化学 的取向必须适当。 (供药学类及医学俭验专业用)
在一定温度下,反应的活化能越大,活化 分子越少,有效碰撞次数就越少,化学反应速 率就越慢;反应的活化能越小,活化分子越多, 有效碰撞次数就越多,化学反应速率就越快。 除了要考虑反应物分子间的碰撞频率和反 应物的活化能外,还要考虑碰撞时分子的空间 取向。活化分子要发生有效碰撞,它们彼此间 的取向必须适当
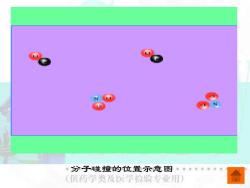
分子碰撞的位置示意图 (供药学类及医学检验专业用)
分子碰撞的位置示意图
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第三章 化学平衡.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第二章 化学热力学基础.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第九章 核酸的化学.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第七章 脂类代谢 Metabolism of Lipid.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第五章 生物氧化.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第四章 维生素与辅酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第三章 酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第二章 蛋白质.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十一章 基因表达调控(Control of Gene Expression).ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十章 遗传信息的传递和表达.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十四章 过渡元素 ⅣB-ⅦB Ⅷ.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十三章 配位化合物.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十二章 S区元素.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十一章 P区元素.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第九章 电解质溶液.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第八章 溶液.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第七章 化学平衡.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第六章 化学反应速率.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第五章 化学热力学初步.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第五章 酸碱解离平衡.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第六章 难溶强电解质的沉淀-溶解平衡.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第七章 氧化还原反应和电极电势.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第八章 原子结构和元素周期律.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第九章 离子键和离子晶体.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十章 共价键与分子结构.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十一章 配位化合物.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十二章 s 区元素.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十三章 p区元素(一).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十四章 p区元素(二).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十五章 d区元素(一).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十六章 d区元素(二).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十七章 ds区元素.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第一章 有机化学基础知识 organic chemistry.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第二章 烷烃和环烷烃 Alkane and Cycloalkane.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第三章 对映异构.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第四章 烯烃和炔烃 Alkene and Alkyne.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第五章 芳香烃 Aromatic hydrocarbon.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第六章 卤代烃 Halohydrocarbon.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第九章 醛、酮和醌.ppt
