哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十章 共价键与分子结构

第十章 共价键与分子结构 第一节 现代价键理论 第二节 轨道杂化理论 第三节 价层电子对互斥理论 第四节 分子轨道理论 第五节 离域π键 第六节 分子间作用力和氢键 第七节 原子晶体和分子晶体
第一节 现代价键理论 第二节 轨道杂化理论 第三节 价层电子对互斥理论 第四节 分子轨道理论 第五节 离域π键 第六节 分子间作用力和氢键 第七节 原子晶体和分子晶体 第十章 共价键与分子结构

第一节现代价键理论 一、共价键的本质 二、价键理论的基本要点 三、共价键的类型 四、配位共价键 五、共价键参数
第一节 现代价键理论 一、共价键的本质 二、价键理论的基本要点 三、共价键的类型 四、配位共价键 五、共价键参数

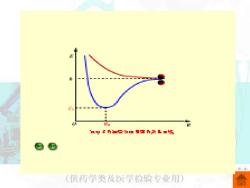
一、共价键的本质 1916年,美国化学家路易斯提出了经典共价 键理论。路易斯认为:分子中的每个原子都有达 到稳定的稀有气体结构的倾向,在非金属原子组 成的分子中,原子达到稀有气体稳定结构不是通 过电子的得失,而是通过共用一对或几对电子实 现的。这种由共用电子对所形成的化学键称为共 价键。 海特勒和伦敦用量子力学处理氢分子形成的 过程中,得到氢分子的能量与核间距之间的关系 曲线。 (供药学类及医学检验专业用)
1916 年,美国化学家路易斯提出了经典共价 键理论。路易斯认为:分子中的每个原子都有达 到稳定的稀有气体结构的倾向,在非金属原子组 成的分子中,原子达到稀有气体稳定结构不是通 过电子的得失,而是通过共用一对或几对电子实 现的。这种由共用电子对所形成的化学键称为共 价键。 海特勒和伦敦用量子力学处理氢分子形成的 过程中,得到氢分子的能量与核间距之间的关系 曲线。 一、共价键的本质
aH平hG凸▣■四h头L■5 ● (供药学类及医学检验专业用)

如果两个氢原子的电子自旋相反。当它们相 互接近时,随着核间距减小,两个氢原子的1S轨 道发生重叠,两个原子核间形成一个电子出现的 概率密度较大的区域,既降低了两个原子核间的 正电排斥,又增加了两个原子核对核间电子出现 的概率密度较大区域的吸引,系统能量逐渐降低, 当核间距减小到平距离时,能量降低到最低值, 两个氢原子形成氢分子。 (供药学类及医学检验专业用
如果两个氢原子的电子自旋相反。当它们相 互接近时,随着核间距减小,两个氢原子的 1s 轨 道发生重叠,两个原子核间形成一个电子出现的 概率密度较大的区域,既降低了两个原子核间的 正电排斥,又增加了两个原子核对核间电子出现 的概率密度较大区域的吸引,系统能量逐渐降低, 当核间距减小到平衡距离时,能量降低到最低值, 两个氢原子形成氢分子

如果两个氢原子的电子自旋相同,随着核 间距的减小,两个原子核间电子出现的概率密 度降低,增大了两个原子核的排斥力,系统能 量逐渐升高,且比两个远离的氢原子能量高, 不能形成稳定的氢分子。 无机化学 (供药学类及医学检验专业用)
如果两个氢原子的电子自旋相同,随着核 间距的减小,两个原子核间电子出现的概率密 度降低,增大了两个原子核的排斥力,系统能 量逐渐升高,且比两个远离的氢原子能量高, 不能形成稳定的氢分子

国家规课 两个氢原子相互接近时原子轨道重叠示意图 (供药学类及医学检验专业用)
两个氢原子相互接近时原子轨道重叠示意图

二、 价键理论的基本要点 价键理论的基本要点是: (1)两个原子接近时,自旋方式相反的未成对 电子可以配对形成共价键。 (2)一个原子含有几个未成对电子,通常就能 与其他原子的几个自旋方式相反的未成对电子配对 形成共价键。一个原子所形成的共价键的数目,受 未成对电子数目的限制,这就是共价键的饱和性。 (3)成键的原子轨道重叠越多,两核间电子出 现的概率密度就越大,形成的共价键就越牢固。在 可能情况下,共价键总是沿着原子轨道最大重叠的 方向形成,这就是共价键的方向性。用
二、价键理论的基本要点 价键理论的基本要点是: (1)两个原子接近时,自旋方式相反的未成对 电子可以配对形成共价键。 (2)一个原子含有几个未成对电子,通常就能 与其他原子的几个自旋方式相反的未成对电子配对 形成共价键。一个原子所形成的共价键的数目,受 未成对电子数目的限制,这就是共价键的饱和性。 (3)成键的原子轨道重叠越多,两核间电子出 现的概率密度就越大,形成的共价键就越牢固。在 可能情况下,共价键总是沿着原子轨道最大重叠的 方向形成,这就是共价键的方向性
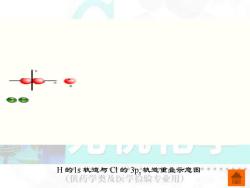
H的1s轨道与Cl的3p,轨道重叠示意图。· 供药学类及医学脸验专业用)
H 的1s 轨道与 Cl 的 3px 轨道重叠示意图

三、共价键的类型 (一))0键 原子轨道沿键轴(两原子核间联线)方向 以“头碰头”十方式重叠所形成的共价键称为 键。形成σ键时,原子轨道的重叠部分对于键 轴呈圆柱形对称,沿键轴方向旋转任意角度, 轨道的形状和符号均不改变。 无机化学 (供药学类及医学检验专业用)
三、共价键的类型 (一)σ键 原子轨道沿键轴(两原子核间联线)方向 以 “头碰头” 方式重叠所形成的共价键称为 σ键。形成σ键时,原子轨道的重叠部分对于键 轴呈圆柱形对称,沿键轴方向旋转任意角度, 轨道的形状和符号均不改变
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第九章 离子键和离子晶体.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第八章 原子结构和元素周期律.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第七章 氧化还原反应和电极电势.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第六章 难溶强电解质的沉淀-溶解平衡.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第五章 酸碱解离平衡.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第四章 化学反应速率.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第三章 化学平衡.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第二章 化学热力学基础.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第九章 核酸的化学.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第七章 脂类代谢 Metabolism of Lipid.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第五章 生物氧化.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第四章 维生素与辅酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第三章 酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第二章 蛋白质.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十一章 基因表达调控(Control of Gene Expression).ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十章 遗传信息的传递和表达.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十四章 过渡元素 ⅣB-ⅦB Ⅷ.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十三章 配位化合物.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十二章 S区元素.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十一章 配位化合物.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十二章 s 区元素.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十三章 p区元素(一).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十四章 p区元素(二).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十五章 d区元素(一).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十六章 d区元素(二).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十七章 ds区元素.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第一章 有机化学基础知识 organic chemistry.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第二章 烷烃和环烷烃 Alkane and Cycloalkane.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第三章 对映异构.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第四章 烯烃和炔烃 Alkene and Alkyne.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第五章 芳香烃 Aromatic hydrocarbon.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第六章 卤代烃 Halohydrocarbon.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第九章 醛、酮和醌.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十章 羧酸和取代羧酸 Carboxylic Acid and Substituted Carboxylic Acid.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十一章 羧酸衍生物 Derivatives of Carboxylic Acid.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十二章 胺 Amine.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十三章 杂环化合物 Heterocyclic Compound.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十四章 糖类 SACCHARIDE.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十五章 脂类 LIPID.ppt
