哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第五章 酸碱解离平衡

第五章 酸碱解离平 第一节 酸碱理论 第二节 弱酸、弱碱的解离平斯 第三节通 酸、碱溶液H,O或OH-离子浓 度的计算 第四节缓中溶液
第一节 酸碱理论 第二节 弱酸、弱碱的解离平衡 第三节 酸、碱溶液H3O+ 或OH- 离子浓 第五章 酸碱解离平衡 度的计算 第四节 缓冲溶液

第一节 酸碱理论 一、 酸碱电离理论 二、 酸碱质子理论 三、酸碱电子理论 四、软硬酸碱理论
第一节 酸碱理论 一、酸碱电离理论 二、酸碱质子理论 三、酸碱电子理论 四、软硬酸碱理论

一、 酸碱电离理论 酸碱电离理论认为:凡在水溶液中电离出的 阳离子全部是H叶的化合物是酸;电离出的阴离子 全是OH的化合物是碱。酸碱反应的实质就是H 与OH作用生成H,O。 酸碱电离理论的优点是能简便地说明酸碱在 水溶液中的反应。但由于该理论把酸碱仅限于水 溶液中,无法说明非水溶剂中的酸碱性。另外, 电离理论把碱限制为氢氧化物,也无法解释氨水 呈碱性这一事实。 (供药学类及医学检验专业用)
一、酸碱电离理论 酸碱电离理论认为:凡在水溶液中电离出的 阳离子全部是H+的化合物是酸;电离出的阴离子 全是 OH- 的化合物是碱。酸碱反应的实质就是 H+ 与 OH- 作用生成 H2O。 酸碱电离理论的优点是能简便地说明酸碱在 水溶液中的反应。但由于该理论把酸碱仅限于水 溶液中,无法说明非水溶剂中的酸碱性。另外, 电离理论把碱限制为氢氧化物,也无法解释氨水 呈碱性这一事实

二、 酸碱质子理论 (一) 酸和碱的定义 酸碱质子理论认为:凡能给出质子的物质都是 酸, 凡能接受质子的物质都是碱。 款育科学 酸一H十碱 (1)酸失去质子后即成为其共轭碱,碱得到质 子后即成为其共轭酸。 (2)酸和碱可以是中性分子,也可以是阳离子 或阴离子。 (3)有些物质既可以作为酸给出质子,又可以 作为碱接受质子,这些物质称为两性物质。 (4)在质子理论中没有盐的概念。 (5)实际上,在溶液中共轭酸碱对之间并不存 在上述简单平。· 供药学类及医学检验专业用
二、酸碱质子理论 酸碱质子理论认为:凡能给出质子的物质都是 酸,凡能接受质子的物质都是碱。 (1)酸失去质子后即成为其共轭碱,碱得到质 子后即成为其共轭酸。 (2)酸和碱可以是中性分子,也可以是阳离子 或阴离子。 (3)有些物质既可以作为酸给出质子,又可以 作为碱接受质子,这些物质称为两性物质。 (4)在质子理论中没有盐的概念。 (5)实际上,在溶液中共轭酸碱对之间并不存 在上述简单平衡。 酸 H + + 碱 (一)酸和碱的定义

(二) 酸碱反应的实质 酸碱反应的实质是两对共轭酸碱对之间的质 子传递: A1+B2 B,+A 酸碱反应是较强的酸与较强的碱作用,生成 较弱的碱和较弱的酸的过程: 较强酸十较强碱三较弱碱十较弱酸 酸碱质子理论扩大了酸和碱的范围,解决了 非水溶液和气体间的酸碱反应。但是酸碱质子理 论把酸碱只限于质子的给予或接受,不能解释没 有质子传递的酸碱反应。 (供药学类及医学检验专业用)
酸碱反应是较强的酸与较强的碱作用,生成 较弱的碱和较弱的酸的过程: 较强酸 + 较强碱 = 较弱碱 + 较弱酸 酸碱质子理论扩大了酸和碱的范围,解决了 非水溶液和气体间的酸碱反应。但是酸碱质子理 论把酸碱只限于质子的给予或接受,不能解释没 有质子传递的酸碱反应。 A B B A 1 2 1 2 + + + H 酸碱反应的实质是两对共轭酸碱对之间的质 子传递: (二)酸碱反应的实质

三、 酸碱电子理论 酸碱电子理论认为:凡是能接受电子对的物 质就是酸;凡是能给出电子对的物质就是碱。酸 碱反应的实质是碱提供电子对,与酸形成配位键 而生成酸碱配合物: 酸十碱→酸碱配合物 酸碱电子理论是目前应用最为广泛的酸碱理 论。但酸碱电子理论对酸碱认识过于笼统,因而 不易掌握酸碱的特征,也使不同类型反应之间的 界限基本消除,最大的缺点是不易确定酸碱的相 对强度。 (供药学类及医学检验专业用
三、酸碱电子理论 酸碱电子理论认为:凡是能接受电子对的物 质就是酸;凡是能给出电子对的物质就是碱。酸 碱反应的实质是碱提供电子对,与酸形成配位键 而生成酸碱配合物: 酸 + 碱 酸碱配合物 酸碱电子理论是目前应用最为广泛的酸碱理 论。但酸碱电子理论对酸碱认识过于笼统,因而 不易掌握酸碱的特征,也使不同类型反应之间的 界限基本消除,最大的缺点是不易确定酸碱的相 对强度。 ⎯⎯→

四、软硬酸碱理论 (一)软硬酸碱的分类 根据路易斯酸的性质的不同,皮尔逊把酸分 为硬酸、软酸和交界酸三类: (1)硬酸:硬酸是半径较小,电荷数大,对 外层电子的吸引力强的阳离子。 (2)软酸:软酸是半径较大,电荷数小,对 外层电子的吸引力弱的阳离子。 (3)交界酸:介于硬酸和软酸之间的酸称为 交界酸。 G儿心 (供药学类及医学检验专业用)
四、软硬酸碱理论 (一)软硬酸碱的分类 根据路易斯酸的性质的不同,皮尔逊把酸分 为硬酸、软酸和交界酸三类: (1)硬酸:硬酸是半径较小,电荷数大,对 外层电子的吸引力强的阳离子。 (2)软酸:软酸是半径较大,电荷数小,对 外层电子的吸引力弱的阳离子。 (3)交界酸:介于硬酸和软酸之间的酸称为 交界酸

根据路易斯碱的性质的不同,分为硬碱、 软碱和交界碱三类: (1)硬碱;硬碱中给出电子的原子或阴离 子的电负性大、半径小,不易失去电子。 (2)软碱;软碱中给出电子的原子或阴离 子的电负性小、半径大,易失去电子。 (3)交界碱:介于硬碱和软碱之间的碱称 为交界碱。 无机化学 (供药学类及医学检验专业用
根据路易斯碱的性质的不同,分为硬碱、 软碱和交界碱三类: (1)硬碱;硬碱中给出电子的原子或阴离 子的电负性大、半径小,不易失去电子。 (2)软碱;软碱中给出电子的原子或阴离 子的电负性小、半径大,易失去电子。 (3)交界碱:介于硬碱和软碱之间的碱称 为交界碱
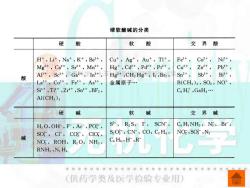
硬软酸碱的分类 硬 酸 软 酸 交界酸 H+,Lit,Na+,K+,Be2+, Cu+,Ag+,Aut,TI+, Fe2+, Co2+, Ni2+, Mg2+,Ca2+,Sr2+,Mn2+, Hg+,Cd2+,Pd2+,Pt2+, Cu2+, Zn2+,Pb2+, 酸 AI+,Sc3+,Ga+,1n3+, Hg2+,CH]Hg,I,Bra, Sn2+, Sb3+, B3+, La3+,Co3+,Fe3+,As3+, 金属原子. B(CH3)3,SO2,NO, Si'+,Tit+,Zr'+,Sn'+,BF3, C H GaH3. A1(CH3)3 硬 碱 软 碱 交界碱 H2O,OH-,F,Ac,PO, S,R2S,I, SCN-, C.Hs NH2,N3,Br, SO,CF,CO,CIO, S2O,CN-,CO,C2 H, NO2,SO,N2 NO,ROH,R2O,NH3, Cs Hs,H-,R RNH2,N2H (供药学类及医学检验专业用)

(二)软硬酸碱规则 软硬酸碱规则的含意是:硬酸与硬碱或软酸 与软碱都可以形成稳定的配合物;硬酸与软碱或 软酸与硬碱形成的配合物不够稳定;交界酸与软 碱或硬碱及交界碱与软酸或硬酸都能发生反应, 所生成的配合物的稳定性介于上述两类配合物之 间。 利用软硬酸碱规则可以判断配合物的稳定性 和预测有关化学反应的方向。一切化学反应都有 朝着硬酸与硬碱结合或软酸与软碱结合的方向进 行的趋势。 (供药学类及医学检验专业用)
软硬酸碱规则的含意是:硬酸与硬碱或软酸 与软碱都可以形成稳定的配合物;硬酸与软碱或 软酸与硬碱形成的配合物不够稳定;交界酸与软 碱或硬碱及交界碱与软酸或硬酸都能发生反应, 所生成的配合物的稳定性介于上述两类配合物之 间。 利用软硬酸碱规则可以判断配合物的稳定性 和预测有关化学反应的方向。一切化学反应都有 朝着硬酸与硬碱结合或软酸与软碱结合的方向进 行的趋势。 (二)软硬酸碱规则
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第四章 化学反应速率.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第三章 化学平衡.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第二章 化学热力学基础.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第九章 核酸的化学.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第七章 脂类代谢 Metabolism of Lipid.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第五章 生物氧化.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第四章 维生素与辅酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第三章 酶.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第二章 蛋白质.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十一章 基因表达调控(Control of Gene Expression).ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十章 遗传信息的传递和表达.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十四章 过渡元素 ⅣB-ⅦB Ⅷ.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十三章 配位化合物.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十二章 S区元素.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第十一章 P区元素.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第九章 电解质溶液.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第八章 溶液.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第七章 化学平衡.ppt
- 桂林电子科技大学:《无机化学》课程电子教案(PPT教学课件)第六章 化学反应速率.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第六章 难溶强电解质的沉淀-溶解平衡.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第七章 氧化还原反应和电极电势.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第八章 原子结构和元素周期律.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第九章 离子键和离子晶体.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十章 共价键与分子结构.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十一章 配位化合物.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十二章 s 区元素.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十三章 p区元素(一).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十四章 p区元素(二).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十五章 d区元素(一).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十六章 d区元素(二).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十七章 ds区元素.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第一章 有机化学基础知识 organic chemistry.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第二章 烷烃和环烷烃 Alkane and Cycloalkane.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第三章 对映异构.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第四章 烯烃和炔烃 Alkene and Alkyne.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第五章 芳香烃 Aromatic hydrocarbon.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第六章 卤代烃 Halohydrocarbon.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第九章 醛、酮和醌.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十章 羧酸和取代羧酸 Carboxylic Acid and Substituted Carboxylic Acid.ppt
