《临床生物化学》课程教学资源(实验指导)第17章 神经递质与其他活性物质的测定

F第十七章神经递质与其他生物活性物质的测定神经递质是神经系统进行信息传递过程的媒介物,是化学传递的物质基础。它们含量的高低常与一些神经、精神疾病密切相关。目前已知的神经递质约几十种,由于它们分子量小(般在200以下),所在位置特殊,含量极低(多为ng),因而一般的检测方法较难测定其含量测定神经递质的方法有灵敏高和特异性强的荧光分光光度法、气相色谱质谱法、高效液相色谱法、放射免疫法、酶联免疫法等,其中放射免疫法为临床常规测定方法。本章介绍血清(浆)B-内啡肽、P物质、-氨基丁酸、NO含量的测定。实验123放射免疫法测定β-内啡肽内啡肽(endorphin,EP)是1976年从脑组织分离出的一种吗啡样物质,目前在胃肠道也发现它的存在。在垂体分泌促肾上腺皮质激素(ACTH)的细胞中存在 β-EP的前体阿片促皮素在应激时可分解成ACTH(39肽)和β-脂肪释放激素(βB-LPH,91肽),后者可进一步分解成β-EP(31肽)。α-EP(16肽),-EP(17肽),8-EP(19肽)均为β-EP的C-末端水解的片段。β-EP的N端五肽,即脑啡肽,是具有吗啡样活性的最短肽链。不同种属的β-EP的肽链在第23、27、31位残基上有差别。B-EP主要在小肠发现。【原理】放射免疫法测定β-EP的原理同一般放射免疫分析法相同,一是标记抗原β-EP,二是制备抗血清、三是分离标记抗原-抗体复合物(B)与游离标记抗原(F)。氯胺T法标记β-EP的原理:氯胺T为强氧化剂,能使放射性Nal25I溶液中的阴离子1251氧化成活泼的碘(很可能为I+),这活性碘可取代肽链上的酪氨酸苯环上中的羟基位的一个或两个氢,使之成为含有放射性碘化酪氨酸的多肽链。β-EP属半抗原,必须与蛋白质类载体结合才能形成理想的免疫原,本实验以牛甲状腺球蛋白(TG)作为载体,利用偶联剂碳二亚胺把β-EP与TG连接起来合成免疫原,并以此免疫家兔,获得特异性的β-EP抗血清。本实验的放射免疫分析法采用顺序饱和加样法,即先加标准物β-EP或待测血浆样品与抗血清混匀,进行一定时间(12~24h)的免疫反应。然后再加入标记抗原1251β-EP,与抗体反应,反应24h,最后以活性炭分离B与F,用计数仪测定沉淀物F的cpm,B的计数即T-F-NSB,计算标准管与样品管结合率B/Bo%,根据校正曲线和待测血浆样品的结合率B/Bo%,即可求得血浆中β-EP的含量【试剂】
1 第十七章 神经递质与其他生物活性物质的测定 神经递质是神经系统进行信息传递过程的媒介物,是化学传递的物质基础。它们含量的 高低常与一些神经、精神疾病密切相关。目前已知的神经递质约几十种,由于它们分子量小(一 般在 200 以下),所在位置特殊,含量极低(多为 ng),因而一般的检测方法较难测定其含量。 测定神经递质的方法有灵敏高和特异性强的荧光分光光度法、气相色谱质谱法、高效液相色 谱法、放射免疫法、酶联免疫法等,其中放射免疫法为临床常规测定方法。 本章介绍血清(浆)β-内啡肽、P 物质、γ-氨基丁酸、NO 含量的测定。 实验 123 放射免疫法测定β-内啡肽 内啡肽(endorphin,EP)是 1976 年从脑组织分离出的一种吗啡样物质,目前在胃肠道也发 现它的存在。在垂体分泌促肾上腺皮质激素(ACTH)的细胞中存在 β-EP 的前体阿片促皮素, 在应激时可分解成 ACTH(39 肽)和 β-脂肪释放激素(β-LPH,91 肽),后者可进一步分解成 β-EP(31 肽)。α-EP(16 肽),γ-EP(17 肽),δ-EP(19 肽)均为 β-EP 的 C-末端水解的片段。β-EP 的 N 端五肽,即脑啡肽,是具有吗啡样活性的最短肽链。不同种属的 β-EP 的肽链在第 23、 27、31 位残基上有差别。β-EP 主要在小肠发现。 【原理】 放射免疫法测定β-EP的原理同一般放射免疫分析法相同,一是标记抗原β-EP, 二是制备抗血清、三是分离标记抗原-抗体复合物(B)与游离标记抗原(F)。 氯胺 T 法标记 β-EP 的原理:氯胺 T 为强氧化剂,能使放射性 Na 125I 溶液中的阴离子 125I 氧化成活泼的碘(很可能为 I + ),这活性碘可取代肽链上的酪氨酸苯环上中的羟基位的一个或两 个氢,使之成为含有放射性碘化酪氨酸的多肽链。 β-EP 属半抗原,必须与蛋白质类载体结合才能形成理想的免疫原,本实验以牛甲状腺球 蛋白(TG)作为载体,利用偶联剂碳二亚胺把 β-EP 与 TG 连接起来合成免疫原,并以此免疫家 兔,获得特异性的 β-EP 抗血清。 本实验的放射免疫分析法采用顺序饱和加样法,即先加标准物 β-EP 或待测血浆样品与 抗血清混匀,进行一定时间(12~24h)的免疫反应。然后再加入标记抗原 125I β-EP,与抗体反 应,反应 24h,最后以活性炭分离 B 与 F,用γ计数仪测定沉淀物 F 的 cpm,B 的计数即 T -F-NSB,计算标准管与样品管结合率 B/B0 %,根据校正曲线和待测血浆样品的结合率 B/B0 %,即可求得血浆中 β-EP 的含量。 【试剂】

1.β-EP标准品,分子量为1745。2.0.5mmol/L磷酸盐缓冲液(PBS,pH7.5)3.Nal25I溶液。4.0.2%氯胺T溶液,用0.05mmol/LPBS(pH7.5)现配。5.0.2%偏亚硫酸钠溶液,用0.05mmol/LPBS(pH7.5)配制。6.0.1mol/L醋酸溶液。7.甲状腺球蛋白(TG)。8.碳二亚胺。9.福氏完全佐剂和福氏不完全佐剂。10.百日咳疫苗。11.PELH缓冲液[0.1mol/LPBS(pH7.5),含3mmol/LEDTA-Na2,0.002%洗必泰,0.1%溶菌酶),β-EP标准品、抗血清和1251-B-EP的稀释均用此缓冲液。12.抑肽酶用生理盐水溶解,使之每20u1含500KIU,用于1ml全血13.2%加膜活性炭溶液取活性炭2g,葡聚糖T700.2g,加入0.1mol/LPBS(pH7.5)至100ml,电磁搅拌1h,然后置于4℃备用。【操作步骤】1. 1251-β-EP标记()标记:将β-EP3ug溶解于30u1的0.5mol/LPBS(pH7.5)中,加Nal2512.9X107Bq混匀后加新鲜配制的0.2%氯胺T溶液15u1,迅速振荡混匀,在室温下反应75s,加入还原剂0.2%偏亚硫酸钠溶液40u1终止碘化反应。(2)分离:将标记反应混合物注入Bio-GelP2层析柱(0.75cm×25cm),用0.1mol/L醋酸溶液洗脱,每min收集一管,每管约350ul,共收集60管,测定各收集管的放射性,出现两个峰,第一个峰为1251-β-EP,第二个峰为受损伤的抗原峰,第三个峰为游离的Na1251峰(3)标记抗原的检查:免疫化学活性的检查,以少量标记抗原与过量抗体反应,然后用适当的方法分离B与F,分别测定其放射性,观察其最大结合率,制备良好的标记抗原,其最大结合率往往超过90%,如最大结合率低于70%,则此标记抗原不能使用。若经检查,受损伤的抗原较多,应用适当的方法将之分离除去。此外游离碘(未与抗原结合的游离放射性碘)应小于5%。(4)贮存:合并第一个峰中计数最高的几管,测其比放射性,加入1/8体积的异丙醇,分成若干小份,置于铅罐一20℃贮存可使用2个月,避免反复冻融。2.β-EP抗血清的制备2
2 1.β-EP 标准品,分子量为 1745。 2.0.5mmol/L 磷酸盐缓冲液(PBS,pH7.5)。 3.Na 125I 溶液。 4.0.2%氯胺 T 溶液,用 0.05mmol/L PBS(pH7.5)现配。 5.0.2%偏亚硫酸钠溶液,用 0.05mmol/L PBS(pH7.5)配制。 6.0.1mol/L 醋酸溶液。 7.甲状腺球蛋白(TG)。 8.碳二亚胺。 9.福氏完全佐剂和福氏不完全佐剂。 10.百日咳疫苗。 11.PELH 缓冲液[0.1mol/L PBS (pH7.5),含 3mmol/L EDTA-Na2,0.002%洗必泰,0.1% 溶菌酶],β-EP 标准品、抗血清和 125I-β-EP 的稀释均用此缓冲液。 12.抑肽酶 用生理盐水溶解,使之每 20μl 含 500KIU,用于 1ml 全血。 13.2%加膜活性炭溶液 取活性炭 2g,葡聚糖 T70 0.2g,加入 0.1mol/L PBS(pH7.5)至 100ml,电磁搅拌 1h,然后置于 4℃备用。 【操作步骤】 1.125I-β-EP 标记 (1) 标记:将 β-EP 3μg 溶解于 30μl 的 0.5mol/L PBS (pH7.5)中,加 Na125I 2.9×107 Bq, 混匀后加新鲜配制的 0.2%氯胺 T 溶液 15μl,迅速振荡混匀,在室温下反应 75s,加入还原剂 0.2%偏亚硫酸钠溶液 40μl 终止碘化反应。 (2) 分离:将标记反应混合物注入 Bio-Gel P2 层析柱(0.75cm×25cm),用 0.1mol/L 醋酸 溶液洗脱,每 min 收集一管,每管约 350μl,共收集 60 管,测定各收集管的放射性,出现两 个峰,第一个峰为 125I-β-EP,第二个峰为受损伤的抗原峰,第三个峰为游离的 Na 125I 峰。 (3) 标记抗原的检查:免疫化学活性的检查,以少量标记抗原与过量抗体反应,然后用 适当的方法分离 B 与 F,分别测定其放射性,观察其最大结合率,制备良好的标记抗原,其 最大结合率往往超过 90%,如最大结合率低于 70%,则此标记抗原不能使用。若经检查,受 损伤的抗原较多,应用适当的方法将之分离除去。此外游离碘(未与抗原结合的游离放射性碘) 应小于 5%。 (4) 贮存:合并第一个峰中计数最高的几管,测其比放射性,加入 1/8 体积的异丙醇, 分成若干小份,置于铅罐-20℃贮存可使用 2 个月,避免反复冻融。 2.β-EP 抗血清的制备

(1)免疫原合成:将β-EP1.5mg、TG15mg和碳二亚胺1mg分别溶解于双蒸水1.5ml、1.5ml和1ml双蒸水中,先把β-EP溶液与TG溶液混合,振荡。在不断搅拌下逐滴加入碳二亚胺溶液,加完再搅拌5min,在室温下反应2~3h即可。再加入等体积的福氏完全佐剂,制成乳剂,备用。(2)动物的选择:最常用的动物是家免或豚鼠,本实验选用新西兰纯种兔,雄性,以1.5~2.5kg为佳。多数情况下,并非每只动物都会产生满意的抗体,故往往同时给多个动物接种抗原,以便筛选。(3)免疫原的剂量:一般在0.1~1.0mg/kg体重,本实验选用0.25mgβ-EP/kg体重进行基础免疫,加强免疫时剂量减半。(4)免疫动物接种:常用颈背部皮内多点(20~30个点)注射。基础免疫使用完全佐剂同时在颈部皮下注射百日咳疫苗0.5ml。在基础免疫后15~20d开始加强免疫,每隔2周进行1次,B-EP免疫原的剂量减半,并且改用不完全佐剂,不再注射百日咳疫苗。经过4次(2个月)免疫注射后,隔1个月再加强免疫1次,一一般可获得高效价的抗血清。(5)抗血清效价的测定:从第2次加强开始,于免疫后12天左右,从实验兔耳缘静脉放血1~2ml,分离血清后用琼脂免疫电泳或放射免疫分析方法测定其抗血清效价。最后一次加强免疫后12天左右的抗血清效价可达1:20 000以上,即可通过抽血或动物放血,分离抗血清。(6)放血和分离抗血清:放血前动物应禁食12h,如欲将免疫免保留,则可从耳缘静脉放血或心脏穿刺取血(非致死放血量15~20ml/kg体重)。放血后应由静脉注入等量50%葡萄糖液,补充失血量,才能使动物存活。放血后的动物,经3个月休息后可再次免疫。放血必须在无菌条件下操作,收集的动物血液装入无菌离心管,待凝固后用无菌玻璃棒在无菌条件下把血块与容器壁剥离开,在37℃下放置1h,随后放入4℃过夜,使血清充分析出,次日在无菌条件下将血清吸出转移到无菌管进行分装,每管0.5~1.0ml,冷冻干燥或原液保存在一40℃冰箱内备用。3.血浆β-EP测定与校正曲线的建立((1)血浆样品的处理:空腹时采集肘静脉血2ml,置于预冷含有0.3mol/LEDTA-Na240ul和抑肽酶1000KIU(40ul)的塑料离心管中,充分混匀,迅速3000r/min,4℃离心10min,分离出血浆置于一40℃冰箱保存待测。(2)无肽血浆的制备:在电磁搅拌下,吸取2%加膜活性炭溶液5ml,共2管,离心、弃上清。取健康者血浆5ml,倒入上述活性炭中,加盖,充分振荡10min,离心;上清液倒入另一活性炭管中,振荡10min,再离心,上清液即无肽血浆。血浆中的生物活性肽因被活性
3 (1) 免疫原合成:将 β-EP 1.5mg、TG 15mg 和碳二亚胺 1mg 分别溶解于双蒸水 1.5ml、 1.5ml 和 1ml 双蒸水中,先把 β-EP 溶液与 TG 溶液混合,振荡。在不断搅拌下逐滴加入碳二 亚胺溶液,加完再搅拌 5min,在室温下反应 2~3h 即可。再加入等体积的福氏完全佐剂,制 成乳剂,备用。 (2) 动物的选择:最常用的动物是家兔或豚鼠,本实验选用新西兰纯种兔,雄性,以 1.5~ 2.5kg 为佳。多数情况下,并非每只动物都会产生满意的抗体,故往往同时给多个动物接种抗 原,以便筛选。 (3) 免疫原的剂量:一般在 0.1~1.0mg/kg 体重,本实验选用 0.25mg β-EP/kg 体重进行基 础免疫,加强免疫时剂量减半。 (4) 免疫动物接种:常用颈背部皮内多点(20~30 个点)注射。基础免疫使用完全佐剂, 同时在颈部皮下注射百日咳疫苗 0.5ml。在基础免疫后 15~20d 开始加强免疫,每隔 2 周进行 1 次,β-EP 免疫原的剂量减半,并且改用不完全佐剂,不再注射百日咳疫苗。经过 4 次(2 个 月)免疫注射后,隔 1 个月再加强免疫 1 次,一般可获得高效价的抗血清。 (5) 抗血清效价的测定:从第 2 次加强开始,于免疫后 12 天左右,从实验兔耳缘静脉放 血 1~2ml,分离血清后用琼脂免疫电泳或放射免疫分析方法测定其抗血清效价。最后一次加 强免疫后 12 天左右的抗血清效价可达 1:20 000 以上,即可通过抽血或动物放血,分离抗血 清。 (6) 放血和分离抗血清:放血前动物应禁食 12h,如欲将免疫兔保留,则可从耳缘静脉 放血或心脏穿刺取血(非致死放血量 15~20ml/kg 体重)。放血后应由静脉注入等量 50%葡萄糖 液,补充失血量,才能使动物存活。放血后的动物,经 3 个月休息后可再次免疫。放血必须 在无菌条件下操作,收集的动物血液装入无菌离心管,待凝固后用无菌玻璃棒在无菌条件下 把血块与容器壁剥离开,在 37℃下放置 1h,随后放入 4℃过夜,使血清充分析出,次日在无 菌条件下将血清吸出转移到无菌管进行分装,每管 0.5~1.0ml,冷冻干燥或原液保存在-40℃ 冰箱内备用。 3.血浆 β-EP 测定与校正曲线的建立 (1) 血浆样品的处理:空腹时采集肘静脉血 2ml,置于预冷含有 0.3mol/L EDTA-Na2 40μl 和抑肽酶 1 000 KIU(40μl)的塑料离心管中,充分混匀,迅速 3 000r/min,4℃离心 10min,分 离出血浆置于-40℃冰箱保存待测。 (2) 无肽血浆的制备:在电磁搅拌下,吸取 2%加膜活性炭溶液 5ml,共 2 管,离心、 弃上清。取健康者血浆 5ml,倒入上述活性炭中,加盖,充分振荡 10min,离心;上清液倒入 另一活性炭管中,振荡 10min,再离心,上清液即无肽血浆。血浆中的生物活性肽因被活性
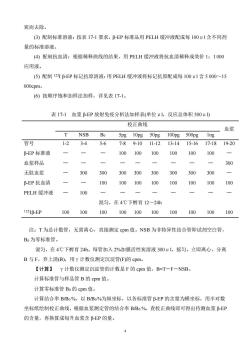
炭而去除。(3)配制标准溶液:按表17-1要求,β-EP标准品用PELH缓冲液配成每100u1含不同剂量的标准溶液。(4)配制抗血清:根据稀释曲线的结果,用PELH缓冲液将抗血清稀释成效价1:1000应用液。(5)配制1251β-EP标记抗原溶液:用PELH缓冲液将标记抗原配成每100u1含5000~15000cpm.(6)按顺序饱和加样法加样,详见表17-1。表 17-1血浆β-EP放射免疫分析法加样表(单位uI,反应总体积500uI)校正曲线血浆NSBBo5pg10pg50pg100pg500pgIng管号1-23-4 5-611-1219-207-89-1013-1415-1617-18B-EP标准液-1100100100100100100300血浆样品300300无肽血浆300300300300300300100 100100β-EP抗血清100100100100 100 PELH缓冲液100-混匀,在4℃下孵育12~24h1251β-EP100100100100100100100100100100注:T为总计数管,无需离心,直接测定cpm值。NSB为非特异性结合管即试剂空白管,Bo为零标准管。混匀,在4℃下孵育24h。每管加入2%加膜活性炭溶液300u1,摇匀,立即离心,分离B与F,弃上清(B),用计数仪测定沉淀管(F)的cpm。【计算】“计数仪测定沉淀管的计数是F的cpm值,B=T-F-NSB。计算标准管与样品管B的cpm值。计算零标准管Bo的cpm值。计算结合率B/Bo%,以B/Bo%为纵坐标,以各标准管β-EP的含量为横坐标,用半对数坐标纸绘制校正曲线,根据血浆测定管的结合率B/Bo%,查校正曲线即可得出待测血浆β-EI的含量,再换算成每升血浆含β-EP的量
4 炭而去除。 (3) 配制标准溶液:按表 17-1 要求,β-EP 标准品用 PELH 缓冲液配成每 100μl 含不同剂 量的标准溶液。 (4) 配制抗血清:根据稀释曲线的结果,用 PELH 缓冲液将抗血清稀释成效价 1:1 000 应用液。 (5) 配制 125I β-EP 标记抗原溶液:用 PELH 缓冲液将标记抗原配成每 100μl 含 5 000~15 000cpm。 (6) 按顺序饱和加样法加样,详见表 17-1。 表 17-1 血浆 β-EP 放射免疫分析法加样表(单位μl,反应总体积 500μl) 校正曲线 血浆 T NSB B0 5pg 10pg 50pg 100pg 500pg 1ng 管号 1-2 3-4 5-6 7-8 9-10 11-12 13-14 15-16 17-18 19-20 β-EP 标准液 — — — 100 100 100 100 100 100 — 血浆样品 — — — — — — — — — 300 无肽血浆 — 300 300 300 300 300 300 300 300 — β-EP 抗血清 — — 100 100 100 100 100 100 100 100 PELH 缓冲液 — 100 — — — — — — — — 混匀,在 4℃下孵育 12~24h 125Iβ-EP 100 100 100 100 100 100 100 100 100 100 注:T 为总计数管,无需离心,直接测定 cpm 值。NSB 为非特异性结合管即试剂空白管, B0 为零标准管。 混匀,在 4℃下孵育 24h。每管加入 2%加膜活性炭溶液 300μl,摇匀,立即离心,分离 B 与 F,弃上清(B),用γ计数仪测定沉淀管(F)的 cpm。 【计算】 γ计数仪测定沉淀管的计数是 F 的 cpm 值,B=T-F-NSB。 计算标准管与样品管 B 的 cpm 值。 计算零标准管 B0 的 cpm 值。 计算结合率 B/B0 %,以 B/B0 %为纵坐标,以各标准管 β-EP 的含量为横坐标,用半对数 坐标纸绘制校正曲线,根据血浆测定管的结合率 B/B0 %,查校正曲线即可得出待测血浆 β-EP 的含量,再换算成每升血浆含 β-EP 的量

【参考范围】536.5±281.4ng/L或307.4土±161.3pmo/L(不同公司的试剂盒参考范围有所不同)。【临床意义】β-EP在镇痛、调节呼吸、循环、消化、免疫、运动功能和丘脑-垂体-肾上腺轴功能方面起重要作用,而且还参与休克、中风、头痛、癫痫和脑脊髓损伤的病理过程。肺炎、无痛性心肌缺血、急性心肌梗塞、心力衰竭、心源性休克、出血性休克、烧伤、多囊卵巢综合征等患者血浆中β-EP升高,颅脑损伤、癫痫等患者的脑脊液中β-EP升高,此外肥胖者血浆 β-EP也可升高。偏头痛、更年期综合征等疾病血浆中 β-EP降低,帕金森病患者脑脊液中 β-EP 降低。【注意事项】目前临床检测β-EP多采用放射免疫试剂盒,标记抗原和抗血清均已制备好,与试剂盒配套供应,检测时只需制备校正曲线和样品,按操作规程进行操作,大大简化了实验过程。但由于不同厂家生产的试剂盒,由于方法学及抗血清特异性的差异,测定值可能会有差别,参考范围也有所不同。【评价】最小检出量0.5pg/管,回收率为94~103%,批内CV为5%,批间CV<12%。实验124放射免疫法测定血浆P物质【原理】P物质(substanceP,SP)于1931年发现,是最早发现的一种神经肽。1971年证明它是11 肽(Arg-Pro-Lys-Pro-Gln-GIn-Phe-Phe-Gly-Leu-Met-NH2),分子量为1348。目前已可人工合成纯品。由于血浆中SP含量低,临床上多采用灵敏度高的放射免疫法进行检测其含量。放射免疫分析法原理基本同实验123,一是标记抗原125ISP、二是制备SP抗血清、三是分离标记抗原-抗体复合物(B)与游离标记抗原(F),用-计数仪计数B的放射活性,根据校正曲线和待测血浆样品的结合率B/Bo%,即可求得血浆中SP的含量。【试剂】1.PELH缓冲液[0.1mol/LPBS(pH7.5),含3mmol/LEDTA-Na2,0.002%洗必泰,0.1%溶菌酶],SP标准品、抗血清和 1251-SP的稀释均用此缓冲液。2.SP贮存液取SP(纯度97%)1.4mg溶于0.1mol/L醋酸100ml中,此液浓度约为10umol/L,然后用PELH缓冲液稀释至100nmol/L,分装,一20℃保存。3.SP工作液取贮存液,用PELH缓冲液稀释至80和240pmol/L两种浓度4.0.5mmol/L磷酸盐缓冲液(PBS,pH7.5)。5.0.1mol/L醋酸溶液。6.甲状腺球蛋白(TG)
5 【参考范围】 536.5±281.4ng/L 或 307.4±161.3 pmol/L (不同公司的试剂盒参考范围有 所不同)。 【临床意义】 β-EP 在镇痛、调节呼吸、循环、消化、免疫、运动功能和丘脑-垂体-肾 上腺轴功能方面起重要作用,而且还参与休克、中风、头痛、癫痫和脑脊髓损伤的病理过程。 肺炎、无痛性心肌缺血、急性心肌梗塞、心力衰竭、心源性休克、出血性休克、烧伤、多囊 卵巢综合征等患者血浆中 β-EP 升高,颅脑损伤、癫痫等患者的脑脊液中 β-EP 升高,此外肥 胖者血浆 β-EP 也可升高。偏头痛、更年期综合征等疾病血浆中 β-EP 降低,帕金森病患者脑 脊液中 β-EP 降低。 【注意事项】 目前临床检测 β-EP 多采用放射免疫试剂盒,标记抗原和抗血清均已制备 好,与试剂盒配套供应,检测时只需制备校正曲线和样品,按操作规程进行操作,大大简化 了实验过程。但由于不同厂家生产的试剂盒,由于方法学及抗血清特异性的差异,测定值可 能会有差别,参考范围也有所不同。 【评价】 最小检出量 0.5pg/管,回收率为 94~103%,批内 CV 为 5%,批间 CV<12%。 实验 124 放射免疫法测定血浆 P 物质 【原理】 P 物质(substance P,SP)于 1931 年发现,是最早发现的一种神经肽。1971 年 证明它是 11 肽(Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-Gly-Leu-Met-NH2),分子量为 1348。目前已 可人工合成纯品。由于血浆中 SP 含量低,临床上多采用灵敏度高的放射免疫法进行检测其含 量。放射免疫分析法原理基本同实验 123,一是标记抗原 125I SP、二是制备 SP 抗血清、三是 分离标记抗原-抗体复合物(B)与游离标记抗原(F),用γ-计数仪计数 B 的放射活性,根据校正 曲线和待测血浆样品的结合率 B/B0 %,即可求得血浆中 SP 的含量。 【试剂】 1.PELH 缓冲液[0.1mol/L PBS (pH7.5),含 3mmol/L EDTA-Na2,0.002%洗必泰,0.1%溶 菌酶],SP 标准品、抗血清和 125I-SP 的稀释均用此缓冲液。 2.SP 贮存液 取 SP(纯度 97%) 1.4mg 溶于 0.1mol/L 醋酸 100ml 中,此液浓度约为 10 μmol/L,然后用 PELH 缓冲液稀释至 100nmol/L,分装,-20℃保存。 3.SP 工作液 取贮存液,用 PELH 缓冲液稀释至 80 和 240 pmol/L 两种浓度。 4.0.5mmol/L 磷酸盐缓冲液(PBS,pH7.5)。 5.0.1mol/L 醋酸溶液。 6.甲状腺球蛋白(TG)

7.琥珀酸酐。8.碳二亚胺。9.福氏完全佐剂和福氏不完全佐剂。10.百日咳疫苗。11.抑肽酶用生理盐水溶解,使之每20ul含500KIU,用于1ml全血。12.石油醚。13.丙酮。14.2%加膜活性炭溶液取活性炭2g,葡聚糖T700.2g,加入0.1mol/LPBS(pH7.5)至100ml,电磁搅拌1h,然后置于4℃备用。【操作步骤】1.1251-SP标记常规氯胺T法,生产厂家已标记好,试剂盒配套供应,临用前用PELH缓冲液稀释至每100u1含有2.5fmol(相当于5000cpm)。2.抗血清的制备(1)琥珀酰甲状腺球蛋白(S-TG)的制备:取牛甲状腺球蛋白(TG)100mg溶于20ml生理盐水,置磁力搅拌器上,再加入固体琥珀酸酐200mg,室温下继续搅拌30~60min,用0.5mol/LNaOH调至pH7~9,再放置2h。经蒸馏水透析除去未结合的琥珀酸,冷冻干燥,即得S-TG。(2)免疫原的合成:取S-TG20mg于带锥形离心管中,加入0.01mol/L磷酸盐缓冲液(PBSpH7.5)2.0ml溶解。另取SP15mg溶于1.5m10.1mol/LPBS(pH7.5)中。向S-TG液中加碳二亚胺50mg,同时取SP液1.0ml也加至S-TG液中,立即混匀,可见絮状物出现,置4C反应10h,中间每4h混合一次。反应液对0.01mo/LPBS(pH7.5)透析24h,中间更换PBS两次。(3)免疫注射:选择健康成年雄性新西兰纯种兔5只,首先于背部皮下注射百日咳疫苗0.5ml。2d后,按每只免注射免疫原0.5mg的福氏完全佐剂乳化液,注射部位为颈背部两侧皮下30~50点。加强免疫每2周1次,免疫原剂量为0.25mg于福氏不完全佐剂中乳化,经过4次(2个月)免疫注射后,隔1个月再加强免疫1次,一般或获得高效价的抗血清。(4)滴度测定:将抗血清用PELH缓冲液稀释1:100~1:10000,各取100u1(5000cpm相当于2.5fmol),温育一定时间后,加入分离剂,分离B与F,以结合率30%为抗血清的工作稀释度,并要求此稀释度抗血清,当加入SP50fmol时,置换零标准管标记抗原的80~90%。只有具备这一条件的抗血清,才有较高的灵敏度。般来说,抗血清也由试剂盒配套供应。3.血浆SP测定与校正曲线的建立(1)血样的采集处理:空腹时取肘静脉血3ml,注入含有30ul1%肝素和1500KIU抑菌肽
6 7.琥珀酸酐。 8.碳二亚胺。 9.福氏完全佐剂和福氏不完全佐剂。 10.百日咳疫苗。 11.抑肽酶 用生理盐水溶解,使之每 20μl 含 500KIU,用于 1ml 全血。 12.石油醚。 13.丙酮。 14.2%加膜活性炭溶液 取活性炭 2g,葡聚糖 T70 0.2g,加入 0.1mol/L PBS(pH7.5)至 100ml,电磁搅拌 1h,然后置于 4℃备用。 【操作步骤】 1.125I-SP 标记 常规氯胺 T 法,生产厂家已标记好,试剂盒配套供应,临用前用 PELH 缓冲液稀释至每 100μl 含有 2.5fmol(相当于 5 000cpm)。 2.抗血清的制备 (1) 琥珀酰甲状腺球蛋白(S-TG)的制备:取牛甲状腺球蛋白(TG)100mg 溶于 20ml 生理盐 水,置磁力搅拌器上,再加入固体琥珀酸酐 200mg,室温下继续搅拌 30~60min,用 0.5mol/L NaOH 调至 pH7~9,再放置 2h。经蒸馏水透析除去未结合的琥珀酸,冷冻干燥,即得 S-TG。 (2)免疫原的合成:取 S-TG 20mg 于带锥形离心管中,加入 0.01mol/L 磷酸盐缓冲液(PBS, pH7.5)2.0ml 溶解。另取 SP 15mg 溶于 1.5ml 0.1 mol/L PBS(pH7.5)中。向 S-TG 液中加碳二亚 胺 50mg,同时取 SP 液 1.0ml 也加至 S-TG 液中,立即混匀,可见絮状物出现,置 4℃反应 10h,中间每 4h 混合一次。反应液对 0.01mol/L PBS(pH7.5)透析 24h,中间更换 PBS 两次。 (3) 免疫注射:选择健康成年雄性新西兰纯种兔 5 只,首先于背部皮下注射百日咳疫苗 0.5ml。2d 后,按每只兔注射免疫原 0.5mg 的福氏完全佐剂乳化液,注射部位为颈背部两侧皮 下 30~50 点。加强免疫每 2 周 1 次,免疫原剂量为 0.25mg 于福氏不完全佐剂中乳化,经过 4 次(2 个月)免疫注射后,隔 1 个月再加强免疫 1 次,一般或获得高效价的抗血清。 (4) 滴度测定:将抗血清用 PELH 缓冲液稀释 1:100~1:10 000,各取 100μl(5 000cpm 相当于 2.5fmol),温育一定时间后,加入分离剂,分离 B 与 F,以结合率 30%为抗血清的工 作稀释度,并要求此稀释度抗血清,当加入 SP 50 fmol 时,置换零标准管标记抗原的 80~90%。 只有具备这一条件的抗血清,才有较高的灵敏度。 一般来说,抗血清也由试剂盒配套供应。 3.血浆 SP 测定与校正曲线的建立 (1) 血样的采集处理:空腹时取肘静脉血 3ml,注入含有 30μl 1%肝素和 1500 KIU 抑菌肽
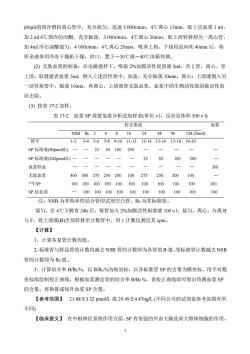
(60ul)的预冷塑料离心管中,充分混匀,迅速3000r/min,4℃离心15min,取上层血浆1ml加2ml4℃预冷的丙酮,充分振荡,3000r/min,4℃离心20min,取上清转移到另一离心管加4ml冷石油醚混匀,4000r/min,4℃离心20min,吸弃上相,下相用凉风吹40min后,将所余液体用冷冻干燥机干燥,封口,置于一30℃或一40℃冰箱待测。(2)无肽血浆的制备:在电磁搅拌下,吸取2%加膜活性炭溶液5ml,共2管,离心、弃上清。取健康者血浆5ml,倒入上述活性炭中,加盖,充分振荡10min,离心;上清液倒入另一活性炭管中,振荡10min,再离心,上清液即无肽血浆。血浆中的生物活性肽因被活性炭而去除。(3)按表17-2加样。表17-2血浆SP放射免疫分析法加样表(单位μ1,反应总体积500uμl)校正曲线血浆NSBBo2244896128 (fmol)416管号11-1213-1415-166 17-1819-201-2 3-45-67-89-10一SP标准液(80pmol/L)2002550100200一SP 标准液(240pmol/L)2550100 300血浆样品1一100无肽血浆400275250100275250200300200/1001251 SP100100100100100100100100100100SP抗血清100100100100100100100100100100注:NSB为非特异性结合管即试剂空白管,Bo为零标准管。混匀,在4℃下孵育24h后,每管加入2%加膜活性炭溶液100ul,摇匀,离心,分离B与F,将上清液(B)全部转移至计数管中,用计数仪测定其cpm【计算】1.计算各复管计数均值。2.标准管与样品管的计数均减去NSB管的计数即为各管的B值,零标准管计数减去NSB管的计数即为Bo值。3.计算结合率B/Bo%,以B/Bo%为纵坐标,以各标准管SP的含量为横坐标,用半对数坐标纸绘制校正曲线,根据血浆测定管的结合率B/Bo%,查校正曲线即可得出待测血浆SP的含量,再换算成每升血浆SP含量【参考范围】21.88±3.32pmol/L或29.49±4.47ng/L(不同公司的试剂盒参考范围有所不同)【临床意义】在中枢神经系统作用方面,SP有很强的兴奋大脑皮质大锥体细胞的作用
7 (60μl)的预冷塑料离心管中,充分混匀,迅速 3 000r/min,4℃离心 15min,取上层血浆 1 ml, 加 2 ml 4℃预冷的丙酮,充分振荡,3 000r/min,4℃离心 20min,取上清转移到另一离心管, 加 4ml 冷石油醚混匀,4 000r/min,4℃离心 20min,吸弃上相,下相用凉风吹 40min 后,将 所余液体用冷冻干燥机干燥,封口,置于-30℃或-40℃冰箱待测。 (2) 无肽血浆的制备:在电磁搅拌下,吸取 2%加膜活性炭溶液 5ml,共 2 管,离心、弃 上清。取健康者血浆 5ml,倒入上述活性炭中,加盖,充分振荡 10min,离心;上清液倒入另 一活性炭管中,振荡 10min,再离心,上清液即无肽血浆。血浆中的生物活性肽因被活性炭 而去除。 (3) 按表 17-2 加样。 表 17-2 血浆 SP 放射免疫分析法加样表(单位μl,反应总体积 500μl) 校正曲线 血浆 NSB B0 2 4 8 16 24 48 96 128 (fmol) 管号 1-2 3-4 5-6 7-8 9-10 11-12 13-14 15-16 17-18 19-20 SP 标准液(80pmol/L) — — 25 50 100 200 — — — — — SP 标准液(240pmol/L) — — — — — — 25 50 100 200 — 血浆样品 — — — — — — — — — — 300 无肽血浆 400 300 275 250 200 100 275 250 200 100 — 125I SP 100 100 100 100 100 100 100 100 100 100 100 SP 抗血清 — 100 100 100 100 100 100 100 100 100 100 注:NSB 为非特异性结合管即试剂空白管,B0 为零标准管。 混匀,在 4℃下孵育 24h 后,每管加入 2%加膜活性炭溶液 100μl,摇匀,离心,分离 B 与 F,将上清液(B)全部转移至计数管中,用γ计数仪测定其 cpm。 【计算】 1.计算各复管计数均值。 2.标准管与样品管的计数均减去 NSB 管的计数即为各管的 B 值,零标准管计数减去 NSB 管的计数即为 B0 值。 3.计算结合率 B/B0 %,以 B/B0 %为纵坐标,以各标准管 SP 的含量为横坐标,用半对数 坐标纸绘制校正曲线,根据血浆测定管的结合率 B/B0 %,查校正曲线即可得出待测血浆 SP 的含量,再换算成每升血浆 SP 含量。 【参考范围】 21.88±3.32 pmol/L 或 29.49±4.47ng/L (不同公司的试剂盒参考范围有所 不同) 【临床意义】 在中枢神经系统作用方面,SP 有很强的兴奋大脑皮质大锥体细胞的作用

可增强垂体激素的分泌,在黑质有兴奋神经元的作用,SP可通过增加脊髓运动神经元的兴奋或去极化而特异性易化痛觉通路。在周围神经系统方面,SP可能是眼对化学刺激反应的初级调节者。SP可引起慢的兴奋性突触后电位。在痛觉调制中,SP是第一级伤害性传入纤维末梢释放的兴奋性神经递质,但在中枢神经系统的较高级部位,它又有明显的镇痛作用。对心血管系统的作用,表现在降血压、舒张血管和增加血流量,增加心输出量。SP对胃肠道大部分平滑肌具有很强的刺激效应,可促胃肠道和括约肌收缩,促胃肠蠕动,参与内脏痛觉反射,刺激胆囊收缩。SP作为一种免疫调节肽,既可影响非特异性免疫,又能增强特异性免疫过程SP与下丘脑-垂体系统的神经内分泌功能密切相关。SP作为一种神经递质,在某些神经-精神疾病的病理生理中发挥作用。SP与临床多种疾病关系密切,其浓度升高见于脑梗死急性期,心绞痛,偏头痛、休克,未经治疗的肺癌、二尖瓣狭窄、慢性肾功能衰竭、肺源性心脏病急性发作期等。SP浓度下降见于帕金森病、肾综合征出血热、高血压、妊娠高血压综合征。【注意事项】SP标准液,低温保存较为稳定,要避免反复冻融影响活性,此外SP易被试管表面所吸附,因此不宜配制一组标准工作液。本实验中只配2种(80、240pmol/L)工作标准液,在测定时加入25~200ul,各管含量为2~128fmol,所得结果满意。【评价】本方法以每管加标记抗原2.5fmol,零标准结合管30%(B/T%)时,按取代零标准管10%最小抗原计算灵敏度,最小检出值0.5fmol。批内CV为4~8%,批间CV为12%实验125反相高效液相色谱法测定血清-氨基丁酸【原理】在碱性缓冲液中,-氨基丁酸(-aminobutyricacid,GABA)和内标已氨酸中的氨基与衍生化试剂氯甲酸荔甲酯(FMOC-CI)反应生成具有较强荧光活性衍生化产物,采用柱前反相高效液相色谱法,经Shim-PackCLC-ODS(M)分离柱,根据其理化性质的差异,在分离柱保留时间不同,可与其他氨基酸衍生物分离。用荧光检测器于激发波长254nm,发射波长315nm进行检测,根据不同浓度GABA标准液的峰高或峰面积绘制校正曲线,据此求出血清中GABA含量。【试剂】1.GABA标准贮存液(1mmol/L)称取GABA标准品1.03mg,溶解于0.1mol/LHCI溶液中,并定容至10ml,置4℃保存。2.已氨酸内标液。3.0.01mol/L氯甲酸荔甲酯
8 可增强垂体激素的分泌,在黑质有兴奋神经元的作用,SP 可通过增加脊髓运动神经元的兴奋 或去极化而特异性易化痛觉通路。在周围神经系统方面,SP 可能是眼对化学刺激反应的初级 调节者。SP 可引起慢的兴奋性突触后电位。在痛觉调制中,SP 是第一级伤害性传入纤维末 梢释放的兴奋性神经递质,但在中枢神经系统的较高级部位,它又有明显的镇痛作用。对心 血管系统的作用,表现在降血压、舒张血管和增加血流量,增加心输出量。SP 对胃肠道大部 分平滑肌具有很强的刺激效应,可促胃肠道和括约肌收缩,促胃肠蠕动,参与内脏痛觉反射, 刺激胆囊收缩。SP 作为一种免疫调节肽,既可影响非特异性免疫,又能增强特异性免疫过程。 SP 与下丘脑-垂体系统的神经内分泌功能密切相关。SP 作为一种神经递质,在某些神经-精神 疾病的病理生理中发挥作用。 SP 与临床多种疾病关系密切,其浓度升高见于脑梗死急性期,心绞痛,偏头痛、休克, 未经治疗的肺癌、二尖瓣狭窄、慢性肾功能衰竭、肺源性心脏病急性发作期等。SP 浓度下降 见于帕金森病、肾综合征出血热、高血压、妊娠高血压综合征。 【注意事项】 SP 标准液,低温保存较为稳定,要避免反复冻融影响活性,此外 SP 易 被试管表面所吸附,因此不宜配制一组标准工作液。本实验中只配 2 种(80、240pmol/L)工作 标准液,在测定时加入 25~200μl,各管含量为 2~128fmol,所得结果满意。 【评价】 本方法以每管加标记抗原 2.5fmol,零标准结合管 30%(B/T%)时,按取代零标 准管 10%最小抗原计算灵敏度,最小检出值 0.5fmol。批内 CV 为 4~8%,批间 CV 为 12%。 实验 125 反相高效液相色谱法测定血清γ-氨基丁酸 【原理】 在碱性缓冲液中,γ-氨基丁酸(γ-aminobutyric acid,GABA)和内标己氨酸中 的氨基与衍生化试剂氯甲酸芴甲酯(FMOC-Cl)反应生成具有较强荧光活性衍生化产物,采用 柱前反相高效液相色谱法,经 Shim-Pack CLC-ODS(M)分离柱,根据其理化性质的差异,在 分离柱保留时间不同,可与其他氨基酸衍生物分离。用荧光检测器于激发波长 254nm,发射 波长 315nm 进行检测,根据不同浓度 GABA 标准液的峰高或峰面积绘制校正曲线,据此求出 血清中 GABA 含量。 【试剂】 1.GABA 标准贮存液(1mmol/L) 称取 GABA 标准品 1.03mg,溶解于 0.1mol/L HCl 溶液 中,并定容至 10ml,置 4℃保存。 2.己氨酸内标液。 3.0.01mol/L 氯甲酸芴甲酯

4流动相A0.05mo/L醋酸钠缓冲液:水:四氢呋响:冰乙酸(250:100:15:2.2),5.流动相B乙腈:甲醇(4:1)6.0.5mo/L硼酸钠缓冲液(pH10.0)7.甲醇、乙腈为色谱纯。8.丙酮、正已烷、乙酸乙酯为分析纯【操作方法】1.标本采集与处理取空腹静脉血1ml,血液凝固析出血清,4℃离心,分离出血清后立即置-40℃冷冻保存。分析时,冷冻样品融化后取100u1移入带盖的尖底小塑料管中,加已氨酸内标液20μl,用乙200u1沉淀蛋白。4000r/min,4℃离心15min,上清液用0.4um孔径滤膜过滤。2.衍生化方法取尖底带塞玻管,加0.5mol/L硼酸钠缓冲液(pH10.0)100μ1,丙酮100μl,摇匀,加入过滤后的血清或标准液50μ1,0.01mol/LFMOC-C150u1,震摇30s置室温10min后加入提取剂(正已烷:乙酸乙酯=1:1)1ml,振摇30s,除去过剩的衍生化试剂。3.校正曲线的制作按上述衍生化操作方法分别测定GABA标准液为50、100、200、300、500、700、1000nmol/L7个浓度(加内标20μ1),以两者峰高之比为纵坐标,GABA浓度为横坐标,绘图即得校正曲线或求出直线方程。4.色谱条件(1)分离柱:Shim-PackCLC-ODS(M),4.6mmX150mm,5um。(2)保护柱:MicroPack,4mm×40mm,5um(3)采用二元梯度洗脱,按表17-3程序进行,流量1.2ml/min。表17-3二元梯度洗脱程序t/min304347480XA相/%69 6661580069B 相/%313439 4210010031(4)激发波长254nm,发射波长315nm,灵敏度高档。(5)柱温35℃。根据待测样品峰高,查校正曲线或代入直线方程即可得出样品中GABA的浓【计算】度,最后换算成每升血清中GABA浓度。【参考范围】血清:116±15nmol/L;脑脊液:22.0~66.0μmol/L。【临床意义】GABA是一种重要的抑制性神经递质,对机体正常生理功能起着重要的调节作用,它广泛存在于脊椎动物脑内,外周神经和其他组织中含量很低。GABA的测定对9
9 4.流动相 A 0.05mol/L 醋酸钠缓冲液∶水∶四氢呋喃∶冰乙酸(250∶100∶15∶2.2), 5.流动相 B 乙腈∶甲醇(4∶1) 6.0.5mol/L 硼酸钠缓冲液(pH10.0) 7.甲醇、乙腈为色谱纯。 8.丙酮、正已烷、乙酸乙酯为分析纯 【操作方法】 1.标本采集与处理 取空腹静脉血 1ml,血液凝固析出血清,4℃离心,分离出血清后 立即置-40℃冷冻保存。分析时,冷冻样品融化后取 100μl 移入带盖的尖底小塑料管中,加 己氨酸内标液 20μl,用乙腈 200μl 沉淀蛋白。4 000r/min,4℃离心 15min,上清液用 0.4μ m 孔径滤膜过滤。 2.衍生化方法 取尖底带塞玻管,加 0.5mol/L 硼酸钠缓冲液(pH10.0)100μl,丙酮 100 μl,摇匀,加入过滤后的血清或标准液 50μl,0.01mol/L FMOC-Cl 50μl,震摇 30s;置室温 10min 后加入提取剂(正已烷∶乙酸乙酯=1∶1)1ml,振摇 30s,除去过剩的衍生化试剂。 3.校正曲线的制作 按上述衍生化操作方法分别测定 GABA 标准液为 50、100、200、 300、500、700、1000 nmol/L 7 个浓度(加内标 20μl),以两者峰高之比为纵坐标,GABA 浓 度为横坐标,绘图即得校正曲线或求出直线方程。 4.色谱条件 (1) 分离柱:Shim-Pack CLC-ODS(M),4.6mm×150mm,5μm。 (2) 保护柱:Micro Pack,4mm×40mm,5μm。 (3) 采用二元梯度洗脱,按表 17-3 程序进行,流量 1.2ml/min。 表 17-3 二元梯度洗脱程序 t/min 0 30 35 43 45 47 48 A 相/ % 69 66 61 58 0 0 69 B 相/ % 31 34 39 42 100 100 31 (4) 激发波长 254nm,发射波长 315nm,灵敏度高档。 (5) 柱温 35℃。 【计算】 根据待测样品峰高,查校正曲线或代入直线方程即可得出样品中 GABA 的浓 度,最后换算成每升血清中 GABA 浓度。 【参考范围】 血清:116±15nmol/L;脑脊液:22.0~66.0μmol/L。 【临床意义】 GABA 是一种重要的抑制性神经递质,对机体正常生理功能起着重要的 调节作用,它广泛存在于脊椎动物脑内,外周神经和其他组织中含量很低。GABA 的测定对

很多神经精神性疾病、遗传性疾病的诊断,以及治疗方案的确定和疗效观察,都具有一定的参考价值。【注意事项】1.GABA在体内有游离型和结合型两种形式,其中以结合型为主。后者在常温下易分解为游离型。因此静脉取血后应尽快分离血清并分析,否则应立即置一40℃保存,以防止结合型GABA分解。2.本法以乙睛作为蛋白质沉淀剂,接着用0.4um滤膜手工过滤,既可节约成本,也可获得满意的效果,进样数百次柱效未有明显变化。为延长分离柱的寿命,本实验还在分离柱前加接Micro Pack保护柱。3.本实验流动相B中加入20%的甲醇,目的是使内标能达到与其相邻色谱峰基线分离,流动相B中加入四氢喃,在不影响其分离效果的前提下可使洗脱过程相对缩短。【评价】目前测定GABA的方法有:放射受体法、高效液相色谱法、气相色谱-质谱联用法和细菌荧光酶生物发光分析法。高效液相色谱法在GABA的定量测定方面有一定的优势。由于血液和脑脊液中GABA含量甚微,约在1X10-7mol/L的浓度范围内,故需足够高的检测灵敏度。为提高检测灵敏度,本实验以FMOC-CI作为衍生化试剂,其特点是灵敏度高反应快,产物稳定。本法采用常用的ODS反相柱,不仅适用于氨基酸分析,而且可用于其他物质的分析,价格亦较便宜。本方法采用内标法,其回收率、线性、精密度等性能指标优于外标法。本法的精密度为批内变异系数<4.6%,批间变异系数<6.1%;最低检出限(信噪比=2)为3.1nmol/L;线性范围为50~1000nmol/L;r-0.996;平均回收率为97.1%。实验126重氮化反应法测定血清一氧化氮测定人体内一氧化氮(NO)不但含量少,而且是极不稳定的分子,半寿期仅数秒钟,需要在测定体系中加入一些物质加以保护,因此较难直接测定NO含量。目前已建立了多种测定NO方法,如亚硝酸盐的重氮化反应法、化学发光法、荧光分光光度法、高效离子色谱法、电子顺磁共振法、电极法、甲基血红蛋白法、cGMP法、脑内微透析法、生物检定法等。这里介绍亚硝酸盐的重氮化反应法。【原理】NO化学性质活泼,体内代谢转化为(NO:-)和亚硝酸盐(NO2-),血清 NO;与NO2 浓度之和(NO3 +NO2)才能准确代表体内 NO水平。血浆中 NO易被氧化转变为亚硝酸盐(NO2),后者迅速转化为硝酸盐(NO3~),后两者性质稳定,因而可通过测定NO代谢10
10 很多神经精神性疾病、遗传性疾病的诊断,以及治疗方案的确定和疗效观察,都具有一定的 参考价值。 【注意事项】 1.GABA 在体内有游离型和结合型两种形式,其中以结合型为主。后者在常温下易分解 为游离型。因此静脉取血后应尽快分离血清并分析,否则应立即置-40℃保存,以防止结合 型 GABA 分解。 2.本法以乙腈作为蛋白质沉淀剂,接着用 0.4μm 滤膜手工过滤,既可节约成本,也可 获得满意的效果,进样数百次柱效未有明显变化。为延长分离柱的寿命,本实验还在分离柱 前加接 Micro Pack 保护柱。 3.本实验流动相 B 中加入 20%的甲醇,目的是使内标能达到与其相邻色谱峰基线分离。 流动相 B 中加入四氢呋喃,在不影响其分离效果的前提下可使洗脱过程相对缩短。 【评价】 目前测定 GABA 的方法有:放射受体法、高效液相色谱法、气相色谱-质谱 联用法和细菌荧光酶生物发光分析法。高效液相色谱法在 GABA 的定量测定方面有一定的优 势。由于血液和脑脊液中 GABA 含量甚微,约在 1×10-7mol/L 的浓度范围内,故需足够高的 检测灵敏度。为提高检测灵敏度,本实验以 FMOC-Cl 作为衍生化试剂,其特点是灵敏度高, 反应快,产物稳定。本法采用常用的 ODS 反相柱,不仅适用于氨基酸分析,而且可用于其他 物质的分析,价格亦较便宜。本方法采用内标法,其回收率、线性、精密度等性能指标优于 外标法。 本法的精密度为批内变异系数<4.6%,批间变异系数<6.1%;最低检出限(信噪比=2)为 3.1nmol/L;线性范围为 50~1 000nmol/L;r=0.9996;平均回收率为 97.1%。 实验 126 重氮化反应法测定血清一氧化氮测定 人体内一氧化氮(NO)不但含量少,而且是极不稳定的分子,半寿期仅数秒钟,需要在测 定体系中加入一些物质加以保护,因此较难直接测定 NO 含量。目前已建立了多种测定 NO 方法,如亚硝酸盐的重氮化反应法、化学发光法、荧光分光光度法、高效离子色谱法、电子 顺磁共振法、电极法、甲基血红蛋白法、cGMP 法、脑内微透析法、生物检定法等。这里介 绍亚硝酸盐的重氮化反应法。 【原理】 NO 化学性质活泼,体内代谢转化为(NO3 — )和亚硝酸盐(NO2 — ),血清 NO3 — 与 NO2 —浓度之和(NO3 — + NO2 — )才能准确代表体内 NO 水平。血浆中 NO 易被氧化转变为亚 硝酸盐(NO2 — ),后者迅速转化为硝酸盐(NO3 — ),后两者性质稳定,因而可通过测定 NO 代谢
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《临床生物化学》课程教学资源(实验指导)第16章 肿瘤标志物的测定.doc
- 《临床生物化学》课程教学资源(实验指导)第15章 常用治疗性药物监测.doc
- 《临床生物化学》课程教学资源(实验指导)第14章 常用酶类测定.doc
- 《临床生物化学》课程教学资源(实验指导)第13章 非蛋白含氮化合物及总胆汁酸测定.doc
- 《临床生物化学》课程教学资源(实验指导)第11章 血气分析.doc
- 《临床生物化学》课程教学资源(实验指导)第10章 无机离子及微量元素测定.doc
- 《临床生物化学》课程教学资源(实验指导)第9章 血清(浆)脂类及脂蛋白测定.doc
- 《临床生物化学》课程教学资源(实验指导)第7章 血清(浆)蛋白质测定.doc
- 《临床生物化学》课程教学资源(实验指导)第6章 方法学评价与试剂盒评价实验.doc
- 《临床生物化学》课程教学资源(实验指导)第5章 分子生物学实验技术.doc
- 《临床生物化学》课程教学资源(实验指导)第4章 酶学基本知识实验.doc
- 《临床生物化学》课程教学资源(实验指导)第3章 电泳技术.doc
- 《临床生物化学》课程教学资源(实验指导)第2章 层析技术.doc
- 《临床生物化学》课程教学资源(实验指导)第1章 光谱技术.doc
- 《临床生物化学》课程教学资源(作业习题)第十九章 自动临床生物化学分析仪的应用及评价(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十九章 自动临床生物化学分析仪的应用及评价(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十八章 治疗药物浓度监测(TDM)(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十八章 治疗药物浓度监测(TDM)(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十七章 妊娠的生物化学检验(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十七章 妊娠的生物化学检验(题目).pdf
- 《临床生物化学》课程教学资源(实验指导)第18章 临床化学实验室基础.doc
- 《临床生物化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 《临床生物化学》课程教学资源(PPT课件)第二章 生物化学检验中的诊断酶学.ppt
- 《临床生物化学》课程教学资源(PPT课件)第三章 血浆蛋白质与含氮化合物的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第四章 糖代谢紊乱的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第五章 血浆脂蛋白代谢紊乱的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第六章 电解质和酸碱平衡紊乱的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第七章 骨代谢紊乱及相关元素的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第八章 微量元素与维生素异常的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第九章 营养状况的评估及的生物化学监测.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十章 肝胆疾病的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十一章 肾功能损伤的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十二章 心血管系统疾病的生物化学检测.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十三章 内分泌疾病的生物化学检测.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十四章 消化系统疾病的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十五章 神经系统疾病的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十六章 肿瘤标志物的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十七章 妊娠的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十八章 治疗药物浓度监测.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十九章 自动临床生物化学分析仪的应用及评价.ppt
