《临床生物化学》课程教学资源(实验指导)第4章 酶学基本知识实验

第四章酶学基本知识实验体液中酶活性的测定是临床生化检验的重要组成部分,因此,了解和掌握有关酶活性测定的相关原理、方法、原则及其影响因素是十分必要的。对医学检验专业的学生而言,需要在学习了基本酶学知识与理论的基础上,通过一系列的酶动力学实验,掌握选择酶活性测定的最优条件和建立酶活性的测定方法。酶促反应动力学是研究酶促反应速度及其影响因素的科学,这些影响因素包括温度、pH酶浓度、底物浓度和抑制剂、激活剂等。实验14分离纯化小麦胚芽中酸性磷酸酶要准确了解酶的生物学性质,必须首先将酶提取、纯化出来,然后才能研究纯酶的物理化学性质,以及进一步研究它的分子结构等。这样就必须把混合溶液中的非酶蛋白、其他酶蛋白和大分子化合物予以清除。酶是具有催化活性的蛋白质,一般情况下分离纯化蛋白质的技术都可用于酶蛋白的分离,但分离条件较温和,多采用盐析、透析、电泳、层析及离心等技术,不损伤酶蛋白的高级结构,避免采用高温、过酸、过碱等实验条件。【原理】酸性磷酸酶(acid phosphatase,ACP)在自然界中广泛分布于植物种子、霉菌、以及动物肝脏和前列腺中。植物种子中的ACP在发芽时含量最丰富,随芽胚的生长ACP含量会下降。本实验选用新鲜小麦胚芽作为原料来分离和纯化ACP,具有来源方便、酶含量高等优点。ACP能溶解于稀缓冲液和水中;溶于35%饱和度的硫酸铵溶液中,在57%饱和度的硫酸铵溶液中可沉淀析出;在中性及高温条件下不稳定,在70℃时相对稳定;pH小于6.5时稳定性增加,枸橡酸和乙酸可增加ACP酶溶液的稳定性;Mg2+、Mr2+为ACP激活剂,而Pi、Cu2+、Hg2+、Ag2+、Zn2+、Pb2+、NaF、酒石酸盐、草酸盐和甲醛等是ACP的抑制剂。从小麦胚芽中提取酸性磷酸酶的流程图见图4-1。【试剂】1.饱和(NH4)SO4溶液(pH5.5,4℃)按(NH4)SO476.7g加100ml蒸馏水的比例配制。2.1mol/LMnCl2溶液。3.0.25mol/LEDTA钠盐溶液(pH5.7)
1 第四章 酶学基本知识实验 体液中酶活性的测定是临床生化检验的重要组成部分,因此,了解和掌握有关酶活性测 定的相关原理、方法、原则及其影响因素是十分必要的。对医学检验专业的学生而言,需要 在学习了基本酶学知识与理论的基础上,通过一系列的酶动力学实验,掌握选择酶活性测定 的最优条件和建立酶活性的测定方法。 酶促反应动力学是研究酶促反应速度及其影响因素的科学,这些影响因素包括温度、pH、 酶浓度、底物浓度和抑制剂、激活剂等。 实验 14 分离纯化小麦胚芽中酸性磷酸酶 要准确了解酶的生物学性质,必须首先将酶提取、纯化出来,然后才能研究纯酶的物理 化学性质,以及进一步研究它的分子结构等。这样就必须把混合溶液中的非酶蛋白、其他酶 蛋白和大分子化合物予以清除。 酶是具有催化活性的蛋白质,一般情况下分离纯化蛋白质的技术都可用于酶蛋白的分 离,但分离条件较温和,多采用盐析、透析、电泳、层析及离心等技术,不损伤酶蛋白的高 级结构,避免采用高温、过酸、过碱等实验条件。 【原理】 酸性磷酸酶(acid phosphatase,ACP)在自然界中广泛分布于植物种子、霉菌、 以及动物肝脏和前列腺中。植物种子中的 ACP 在发芽时含量最丰富,随芽胚的生长 ACP 含 量会下降。本实验选用新鲜小麦胚芽作为原料来分离和纯化 ACP,具有来源方便、酶含量高 等优点。 ACP 能溶解于稀缓冲液和水中;溶于 35%饱和度的硫酸铵溶液中,在 57%饱和度的硫酸 铵溶液中可沉淀析出;在中性及高温条件下不稳定,在 70℃时相对稳定;pH 小于 6.5 时稳定 性增加,枸橼酸和乙酸可增加 ACP 酶溶液的稳定性;Mg2+、Mn2+为 ACP 激活剂,而 Pi、Cu2+、 Hg2+、Ag2+、Zn2+、Pb2+、NaF、酒石酸盐、草酸盐和甲醛等是 ACP 的抑制剂。从小麦胚芽中 提取酸性磷酸酶的流程图见图 4-1。 【试剂】 1.饱和(NH4)2SO4 溶液(pH 5.5,4℃) 按(NH4)2SO4 76.7 g 加 100ml 蒸馏水的比例配制。 2.1 mol/L MnCl2 溶液。 3.0.25 mol/L EDTA 钠盐溶液(pH 5.7)

4.甲醇:-30℃预冷。5.新鲜麦芽100g。【操作步骤】1.小麦胚芽的准备选取新鲜、饱满的小麦粒,冷水洗涤后,用冷水浸泡2~4d(天热时需每天换水)使麦粒发胀。将发胀的麦粒放在沥水的塑料筐中,上面覆盖湿的双层纱布,置于通风处,每天浇水2~3次以保持麦粒有一定的湿度。一般情况下,发胀的麦粒在室温20℃经3~7d就可以发出胚芽。在此过程中应注意通风透气,防止麦粒发霉。2.取新鲜小麦胚芽100g加200ml冷蒸馏水在高速、间断条件下捣碎3~5min,得到麦芽匀浆,用2~4层纱布过滤,尽量将液体挤出,弃去纱布上固体物。3.滤液倒入离心管,以4000r/min离心10min。4.弃去沉淀。取上清液记录体积,为上清液1,留10ml于4℃冰箱保存,待作蛋白质和酶活性测定,剩余液体倒入烧杯中。5.向每100ml上清液I中加入2ml的1mol/LMnCl2溶液,并缓慢搅拌混匀。搅拌切勿过快,以免酶蛋白变性并产生大量泡沫6.倒入离心管,以4000r/min离心10min。7.去除沉淀。记录上清液体积,为上清液II,留10ml于4℃冰箱保存,待作蛋白质和酶活性测定,剩余液体倒入烧杯中。8.以54ml饱和(NH4)2SO4/100ml上清液II的比例缓慢加入饱和(NH4)2SO4溶液,在5~10min内加完,轻轻搅拌混匀,使(NH4)2SO4浓度达到35%。加完后继续搅拌10min。9.倒入离心管,以4000r/min离心10min。10.弃去沉淀,取上清液记录体积,为上清液I,留10ml于4℃冰箱保存,待作蛋白质和酶活性测定,剩余液体倒入烧杯中。11.将上述液体在70℃恒温水箱中水浴至62℃2min,迅速用冰水浴冷却至6~8℃12.倒入离心管,以4000r/min离心10min,弃去沉淀。13.以51ml饱和(NH4)2SO4/100ml上清液的比例缓慢加入饱和(NH4)2SO4溶液,轻轻搅拌混匀,使(NH4)2SO4浓度达到57%。14.倒入离心管,以4000r/min离心10min,弃去上清液。15.沉淀用相当于1/3上清液IⅡI体积的蒸馏水溶解、洗涤,以4000r/min离心10min后,弃去沉淀,成为上清液IV,留10ml待作蛋白质和酶活性测定,剩余液体倒入烧杯中。16.剩余的上清液IV按每ml加入0.09ml0.25mol/LEDTA和0.1ml饱和硫酸铵溶液,在缓慢搅拌的条件下,按每ml上清液加2.0ml的比例加入甲醇(一30℃预冷),使蛋白质析出。2
2 4.甲醇:-30℃预冷。 5.新鲜麦芽 100 g。 【操作步骤】 1.小麦胚芽的准备 选取新鲜、饱满的小麦粒,冷水洗涤后,用冷水浸泡 2~4d(天热时 需每天换水)使麦粒发胀。将发胀的麦粒放在沥水的塑料筐中,上面覆盖湿的双层纱布,置于 通风处,每天浇水 2~3 次以保持麦粒有一定的湿度。一般情况下,发胀的麦粒在室温 20℃ 经 3~7d 就可以发出胚芽。在此过程中应注意通风透气,防止麦粒发霉。 2.取新鲜小麦胚芽 100g 加 200ml 冷蒸馏水在高速、间断条件下捣碎 3~5min,得到麦芽 匀浆,用 2~4 层纱布过滤,尽量将液体挤出,弃去纱布上固体物。 3.滤液倒入离心管,以 4 000 r/min 离心 10min 。 4.弃去沉淀。取上清液记录体积,为上清液Ⅰ,留 10ml 于 4℃冰箱保存,待作蛋白质和 酶活性测定,剩余液体倒入烧杯中。 5.向每 100ml 上清液Ⅰ中加入 2ml 的 1 mol/L MnCl2 溶液,并缓慢搅拌混匀。搅拌切勿 过快,以免酶蛋白变性并产生大量泡沫。 6.倒入离心管,以 4 000r/min 离心 10min。 7.去除沉淀。记录上清液体积,为上清液Ⅱ,留 10ml 于 4℃冰箱保存,待作蛋白质和酶 活性测定,剩余液体倒入烧杯中。 8.以 54ml 饱和(NH4)2SO4/100ml 上清液Ⅱ的比例缓慢加入饱和(NH4)2SO4 溶液,在 5~ 10min 内加完,轻轻搅拌混匀,使(NH4)2SO4 浓度达到 35%。加完后继续搅拌 10min。 9.倒入离心管,以 4 000 r/min 离心 10min。 10.弃去沉淀,取上清液记录体积,为上清液Ⅲ,留 10ml 于 4℃冰箱保存,待作蛋白质 和酶活性测定,剩余液体倒入烧杯中。 11.将上述液体在 70℃恒温水箱中水浴至 62℃ 2min,迅速用冰水浴冷却至 6~8℃。 12.倒入离心管,以 4 000 r/min 离心 10min,弃去沉淀。 13.以 51ml 饱和(NH4)2SO4/100ml 上清液的比例缓慢加入饱和(NH4)2SO4 溶液,轻轻搅拌 混匀,使(NH4)2SO4 浓度达到 57%。 14.倒入离心管,以 4 000 r/min 离心 10min,弃去上清液。 15.沉淀用相当于 1/3 上清液Ⅲ体积的蒸馏水溶解、洗涤,以 4 000 r/min 离心 10min 后, 弃去沉淀,成为上清液Ⅳ,留 10ml 待作蛋白质和酶活性测定,剩余液体倒入烧杯中。 16.剩余的上清液Ⅳ按每 ml 加入 0.09ml 0.25mol/L EDTA 和 0.1ml 饱和硫酸铵溶液,在 缓慢搅拌的条件下,按每 ml 上清液加 2.0ml 的比例加入甲醇(-30℃预冷),使蛋白质析出
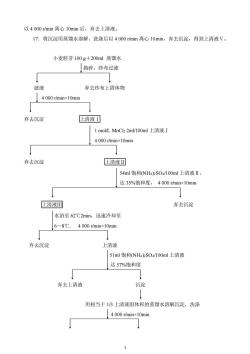
以4000r/min离心10min后,弃去上清液。17.将沉淀用蒸馏水溶解、洗涤后以4000r/min离心10min,弃去沉淀,得到上清液V。小麦胚芽100g+200ml蒸馏水[揭碎,纱布过滤滤液弃去纱布上固体物1 4 000 /minx10minE清液弃去沉淀1mol/LMnClz2ml/100ml上清液I4 000r/minx10min→弃去沉淀E清液54ml饱和(NH4)2SO4/100ml上清液II,达35%饱和度,4000r/min×10min+?上清液弃去沉淀水浴至62℃2min,迅速冷却至6~8℃,4000 r/min×10minI弃去沉淀上清液51ml饱和(NH4)SO4/100ml上清液达57%饱和度弃去上清液沉淀用相当于1/3上清液I体积的蒸馏水溶解沉淀,洗涤4 000 /minx10min↓+
3 以 4 000 r/min 离心 10min 后,弃去上清液。 17.将沉淀用蒸馏水溶解、洗涤后以 4 000 r/min 离心 10min,弃去沉淀,得到上清液Ⅴ。 小麦胚芽 100 g+200ml 蒸馏水 捣碎,纱布过滤 滤液 弃去纱布上固体物 4 000 r/min×10min 弃去沉淀 上清液Ⅰ 1 mol/L MnCl2 2ml/100ml 上清液Ⅰ 4 000 r/min×10min 弃去沉淀 上清液Ⅱ 54ml 饱和(NH4)2SO4/100ml 上清液Ⅱ, 达 35%饱和度, 4 000 r/min×10min 上清液Ⅲ 弃去沉淀 水浴至 62℃2min,迅速冷却至 6~8℃, 4 000 r/min×10min 弃去沉淀 上清液 51ml 饱和(NH4)2SO4/100ml 上清液 达 57%饱和度 弃去上清液 沉淀 用相当于 1/3 上清液Ⅲ体积的蒸馏水溶解沉淀,洗涤 4 000 r/min×10min

弃去沉淀上清液EDTA和-30°℃预冷甲醇沉淀4000 r/min×10min→沉淀弃去上清液1蒸馏水溶解、洗涤,4000 /minx10min+弃去沉淀E清液图4-1小麦胚芽ACP分离纯化主要步骤流程图【注意事项】1.制备小麦胚芽时不宜让麦苗长出,因麦粒和麦苗部分酸性磷酸酶活性较低,同时要弃去发霉变质的胚芽。2.1mol/LMnCh 起稳定酶蛋白并除去杂蛋白的作用。3.ACP溶于35%饱和度的(NH4)SO4溶液中,一些杂蛋白沉淀析出。当饱和度上升至57%时,ACP便沉淀析出,某些杂蛋白仍溶于上清液中。4.ACP在70℃时稳定,加热至62℃以去除一些不耐热的杂蛋白。5.甲醇的作用是降低溶液的介电常数,使酶蛋白脱水析出,从而除去杂蛋白。由于有机溶剂常引起蛋白质的变性,因此,此步的关键在于保持甲醇的低温。实验15酶蛋白含量测定及比活性分析测定各上清液中蛋白质含量和酶活性水平,计算各分离步骤的比活性等指标,可以分析和评价分离纯化的效率,掌握酶分离纯化的基本知识。(一)考马斯亮蓝G-250(CBBG-250)法测定各上清液中蛋白质含量【原理】CBBG-250是双色型蛋白质染料,其游离型呈红棕色,最大吸收峰为465nm在酸性环境下可与蛋白质结合,结合型CBBG-250呈蓝色,最大吸收峰移至595nm。在一定条件下,595nm处的吸光度增加与蛋白质含量成正比。染料与蛋白质能迅速结合,2min内达到平衡,1h内保持稳定状态。【试剂】1.CBBG-250溶液称取考马斯亮蓝G-250100mg,溶于50ml95%乙醇中,加入85%4
4 弃去沉淀 上清液Ⅳ EDTA 和-30℃预冷甲醇沉淀 4 000 r/min×10min 沉淀 弃去上清液 蒸馏水溶解、洗涤,4 000 r/min×10min 弃去沉淀 上清液Ⅴ 图 4-1 小麦胚芽 ACP 分离纯化主要步骤流程图 【注意事项】 1.制备小麦胚芽时不宜让麦苗长出,因麦粒和麦苗部分酸性磷酸酶活性较低,同时要 弃去发霉变质的胚芽。 2.1 mol/L MnCl2 起稳定酶蛋白并除去杂蛋白的作用。 3.ACP 溶于 35%饱和度的(NH4)2SO4 溶液中,一些杂蛋白沉淀析出。当饱和度上升至 57%时,ACP 便沉淀析出,某些杂蛋白仍溶于上清液中。 4.ACP 在 70℃时稳定,加热至 62℃以去除一些不耐热的杂蛋白。 5.甲醇的作用是降低溶液的介电常数,使酶蛋白脱水析出,从而除去杂蛋白。由于有 机溶剂常引起蛋白质的变性,因此,此步的关键在于保持甲醇的低温。 实验 15 酶蛋白含量测定及比活性分析 测定各上清液中蛋白质含量和酶活性水平,计算各分离步骤的比活性等指标,可以分析 和评价分离纯化的效率,掌握酶分离纯化的基本知识。 (一)考马斯亮蓝 G-250(CBBG-250)法测定各上清液中蛋白质含量 【原理】 CBBG-250 是双色型蛋白质染料,其游离型呈红棕色,最大吸收峰为 465nm。 在酸性环境下可与蛋白质结合,结合型 CBBG-250 呈蓝色,最大吸收峰移至 595nm。在一定 条件下,595nm 处的吸光度增加与蛋白质含量成正比。染料与蛋白质能迅速结合,2min 内达 到平衡,1 h 内保持稳定状态。 【试剂】 1. CBBG-250 溶液 称取考马斯亮蓝 G-250 100 mg,溶于 50ml 95%乙醇中,加入 85%
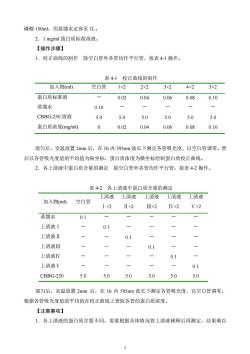
磷酸100ml,用蒸馏水定容至1L。2.1mg/ml蛋白质标准溶液。【操作步骤】1.校正曲线的制作除空白管外各管均作平行管,按表4-1操作。表4-1校正曲线的制作加入物(ml)空白管1×24x22×23×25×2蛋白质标准液0.040.060.080.100.02蒸馏水0.10-一一CBBG-250 溶液5.05.05.05.05.05.00.02蛋白质浓度(mg/ml)00.040.060.080.10混匀后,室温放置2min后,在1h内595nm波长下测定各管吸光度,以空白管调零。然后以各管吸光度值的平均值为纵坐标,蛋白质浓度为横坐标绘制蛋白质校正曲线。2.各上清液中蛋白质含量的测定除空白管外各管均作平行管,按表4-2操作表42各上清液中蛋白质含量的测定上清液上清液上清液上清液上清液加入物(ml)空白管Ix2IIx2II x2IV×2Vx2蒸馏水0.1上清液I0.1 --一--上清液II0一1一上清液IⅢI-0.1 一一上清液IV---/-0.1 ----上清液V0.1 一5.05.05.05.05.0CBBG-2505.0混匀后,室温放置2min后,在1h内595nm波长下测定各管吸光度,以空白管调零。根据各管吸光度值的平均值在校正曲线上查取各管的蛋白质浓度。【注意事项】1.各上清液的蛋白质含量不同,需要根据具体情况将上清液稀释后再测定,结果乘以
5 磷酸 100ml,用蒸馏水定容至 1L。 2.1 mg/ml 蛋白质标准溶液。 【操作步骤】 1.校正曲线的制作 除空白管外各管均作平行管,按表 4-1 操作。 表 4-1 校正曲线的制作 加入物(ml) 空白管 1×2 2×2 3×2 4×2 5×2 蛋白质标准液 - 0.02 0.04 0.06 0.08 0.10 蒸馏水 0.10 - - - - - CBBG-250 溶液 5.0 5.0 5.0 5.0 5.0 5.0 蛋白质浓度(mg/ml) 0 0.02 0.04 0.06 0.08 0.10 混匀后,室温放置 2min 后,在 1h 内 595nm 波长下测定各管吸光度,以空白管调零。然 后以各管吸光度值的平均值为纵坐标,蛋白质浓度为横坐标绘制蛋白质校正曲线。 2.各上清液中蛋白质含量的测定 除空白管外各管均作平行管,按表 4-2 操作。 表 4-2 各上清液中蛋白质含量的测定 混匀后,室温放置 2min 后,在 1h 内 595nm 波长下测定各管吸光度,以空白管调零。 根据各管吸光度值的平均值在校正曲线上查取各管的蛋白质浓度。 【注意事项】 1.各上清液的蛋白质含量不同,需要根据具体情况将上清液稀释后再测定,结果乘以 加入物(ml) 空白管 上清液 Ⅰ×2 上清液 Ⅱ×2 上清液 Ⅲ×2 上清液 Ⅳ×2 上清液 Ⅴ×2 蒸馏水 0.1 - - - - - 上清液Ⅰ - 0.1 - - - - 上清液Ⅱ - - 0.1 - - - 上清液Ⅲ - - - 0.1 - - 上清液Ⅳ - - - - 0.1 - 上清液Ⅴ - - - - - 0.1 CBBG-250 5.0 5.0 5.0 5.0 5.0 5.0

稀释倍数即可。2.本实验中所测得的蛋白质为总蛋白,包括ACP在内的上清液中所有的蛋白质。【评价】CBBG-250染料结合法测定蛋白质含量,具有灵敏度高(通常为2~20ug)、干扰因素小的特点。但线性范围<1.5g/L,与不同蛋白质的结合能力有差异,并且色素易沉着污染比色杯。(二)各上清液中ACP活性测定【原理】ACP能水解磷酸单酯键,释放无机磷酸。ACP的水解作用特异性不高,其天然底物有ATP、ADP和G-6-P等,人工合成的底物有对硝基磷酸酚、磷酸苯二钠等以磷酸苯二钠作为底物,在ACP的作用下被水解生成酚和磷酸。在酸性溶液中酚能与4-氨基安替比林反应,经高铁氰化钾氧化生成红色醒类化合物,在510nm处测定其吸光度值,其颜色深浅与酚的含量成正比,可推算出酶的活性。【试剂】1.酚标准贮存液(1mol/L)称取结晶酚,用0.1mol/L的HCI溶解,并加至总体积后,标定(标定方法:取酚试剂5.0ml,加蒸馏水约50ml,以酚酞作指示剂,用1.0.mol/L的NaOH溶液滴定,求出酚试剂的酸度,最后用蒸馏水定容,使最终的酸度为1.0mol/L)2.酚标准应用液(0.4mmol/L)用标定后的酚标准贮存液加蒸馏水稀释而成。3.0.1mol/L的碳酸盐缓冲液(pH10)称取无水碳酸钠6.36g,碳酸氢钠3.36g,用蒸馏水溶解并稀释至1L。4.4-氨基安替比林(4-AAP)溶液称取4-氨基安替比林6g,用蒸馏水溶解并定容至1L,置棕色瓶中冰箱保存。5.高铁氰化钾溶液称取高铁氰化钾48g,硼酸28g,各自溶解于400ml蒸馏水中,两液合并后再加蒸馏水至1L,置棕色瓶中保存。6.5mmol/L磷酸苯二钠溶液称取磷酸苯二钠0.635g,加入500ml煮沸的蒸馏水中,冷却后加氯仿2ml防腐,冰箱保存。7.0.1mol/L柠檬酸溶液(pH5.0)称取柠檬酸21.014g,加蒸馏水溶解并定容至1L8.0.1mol/L柠檬酸三钠溶液(pH5.0)称取柠檬酸三钠29.410g,加蒸馏水溶解并定容至1L。9.0.1mol/L柠檬酸-柠檬酸三钠缓冲液(pH5.0)每100ml缓冲液按0.1mol/L柠檬酸溶液41ml加0.1mol/L柠檬酸三钠溶液59ml配制而成。【操作步骤】1.校正曲线的制作除第1管以外,其余各管均作平行管,按表4-3操作。6
6 稀释倍数即可。 2.本实验中所测得的蛋白质为总蛋白,包括 ACP 在内的上清液中所有的蛋白质。 【评价】 CBBG-250 染料结合法测定蛋白质含量,具有灵敏度高(通常为 2~20μg)、干 扰因素小的特点。但线性范围<1.5 g/L,与不同蛋白质的结合能力有差异,并且色素易沉着 污染比色杯。 (二)各上清液中 ACP 活性测定 【原理】 ACP 能水解磷酸单酯键,释放无机磷酸。ACP 的水解作用特异性不高,其天 然底物有 ATP、ADP 和 G-6-P 等,人工合成的底物有对硝基磷酸酚、磷酸苯二钠等。 以磷酸苯二钠作为底物,在 ACP 的作用下被水解生成酚和磷酸。在酸性溶液中酚能与 4-氨基安替比林反应,经高铁氰化钾氧化生成红色醌类化合物,在 510nm 处测定其吸光度值, 其颜色深浅与酚的含量成正比,可推算出酶的活性。 【试剂】 1.酚标准贮存液(1 mol/L) 称取结晶酚,用 0.1 mol/L 的 HCl 溶解,并加至总体积后, 标定(标定方法:取酚试剂 5.0ml,加蒸馏水约 50ml,以酚酞作指示剂,用 1.0 mol/L 的 NaOH 溶液滴定,求出酚试剂的酸度,最后用蒸馏水定容,使最终的酸度为 1.0 mol/L) 。 2.酚标准应用液(0.4 mmol/L) 用标定后的酚标准贮存液加蒸馏水稀释而成。 3.0.1 mol/L 的碳酸盐缓冲液(pH 10) 称取无水碳酸钠 6.36 g,碳酸氢钠 3.36 g,用蒸馏 水溶解并稀释至 1 L。 4.4-氨基安替比林(4-AAP)溶液 称取 4-氨基安替比林 6 g,用蒸馏水溶解并定容至 1 L, 置棕色瓶中冰箱保存。 5.高铁氰化钾溶液 称取高铁氰化钾 48 g,硼酸 28 g,各自溶解于 400ml 蒸馏水中, 两液合并后再加蒸馏水至 1 L,置棕色瓶中保存。 6.5 mmol/L 磷酸苯二钠溶液 称取磷酸苯二钠 0.635 g,加入 500ml 煮沸的蒸馏水中, 冷却后加氯仿 2ml 防腐,冰箱保存。 7.0.1 mol/L 柠檬酸溶液(pH 5.0) 称取柠檬酸 21.014 g,加蒸馏水溶解并定容至 1 L。 8.0.1 mol/L 柠檬酸三钠溶液(pH 5.0) 称取柠檬酸三钠 29.410 g,加蒸馏水溶解并定容 至 1 L。 9.0.1 mol/L 柠檬酸-柠檬酸三钠缓冲液(pH 5.0) 每 100ml 缓冲液按 0.1 mol/L 柠檬酸溶 液 41ml 加 0.1 mol/L 柠檬酸三钠溶液 59ml 配制而成。 【操作步骤】 1.校正曲线的制作 除第 1 管以外,其余各管均作平行管,按表 4-3 操作
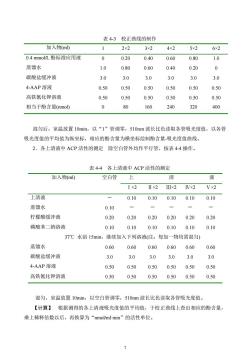
表4-3校正曲线的制作加入物(ml)2×23x25x26x24x210.4mmol/L酚标准应用液00.200.400.600.801.0蒸馏水1.000.800.600.400.20碳酸盐缓冲液3.03.03.03.03.03.04-AAP溶液0.500.500.500.500.500.50高铁氰化钾溶液0.500.500.500.500.500.50080160240320400相当于酚含量(nmol)混匀后,室温放置10min,以“1”管调零,510nm波长比色读取各管吸光度值,以各管吸光度值的平均值为纵坐标,相应的酚含量为横坐标绘制酚含量-吸光度值曲线。2.各上清液中ACP活性的测定除空白管外均作平行管,按表4-4操作。表4-4各上清液中ACP活性的测定加入物(ml)空白管清液上I x211×2IIIx2IV×2V×2上清液0.100.100.100.100.10蒸馏水0.10一1-柠檬酸缓冲液0.200.200.200.200.200.200.100.10磷酸苯二钠溶液0.100.100.100.1037℃水浴15min,继续加入下列溶液(注:每加一物均需混匀)蒸馏水0.60 0.600.600.600.600.60碳酸盐缓冲液3.03.03.03.03.03.04-AAP溶液0.500.500.500.500.500.50高铁氰化钾溶液0.500.500.500.500.500.50混匀,室温放置10min,以空白管调零,510nm波长比色读取各管吸光度值。【计算】根据测得的各上清液吸光度值的平均值,于校正曲线上查出相应的酚含量,乘上稀释倍数以后,再换算为“nmol/ml-min”的活性单位
7 表 4-3 校正曲线的制作 加入物(ml) 1 2×2 3×2 4×2 5×2 6×2 0.4 mmol/L 酚标准应用液 0 0.20 0.40 0.60 0.80 1.0 蒸馏水 1.0 0.80 0.60 0.40 0.20 0 碳酸盐缓冲液 3.0 3.0 3.0 3.0 3.0 3.0 4-AAP 溶液 0.50 0.50 0.50 0.50 0.50 0.50 高铁氰化钾溶液 0.50 0.50 0.50 0.50 0.50 0.50 相当于酚含量(nmol) 0 80 160 240 320 400 混匀后,室温放置 10min,以“1”管调零,510nm 波长比色读取各管吸光度值,以各管 吸光度值的平均值为纵坐标,相应的酚含量为横坐标绘制酚含量-吸光度值曲线。 2.各上清液中 ACP 活性的测定 除空白管外均作平行管,按表 4-4 操作。 表 4-4 各上清液中 ACP 活性的测定 加入物(ml) 空白管 上 清 液 Ⅰ×2 Ⅱ×2 Ⅲ×2 Ⅳ×2 Ⅴ×2 上清液 - 0.10 0.10 0.10 0.10 0.10 蒸馏水 0.10 - - - - - 柠檬酸缓冲液 0.20 0.20 0.20 0.20 0.20 0.20 磷酸苯二钠溶液 0.10 0.10 0.10 0.10 0.10 0.10 37℃ 水浴 15min,继续加入下列溶液(注:每加一物均需混匀) 蒸馏水 0.60 0.60 0.60 0.60 0.60 0.60 碳酸盐缓冲液 3.0 3.0 3.0 3.0 3.0 3.0 4-AAP 溶液 0.50 0.50 0.50 0.50 0.50 0.50 高铁氰化钾溶液 0.50 0.50 0.50 0.50 0.50 0.50 混匀,室温放置 10min,以空白管调零,510nm 波长比色读取各管吸光度值。 【计算】 根据测得的各上清液吸光度值的平均值,于校正曲线上查出相应的酚含量, 乘上稀释倍数以后,再换算为“nmol/ml·min”的活性单位

其中,酶促反应的时间为15min,酶促反应中所用的上清液体积为0.1ml。ACP活性单位的定义:在本实验条件下每分钟每毫升酶液产生1nmol酚(nmol/mlmin)为一个活性单位。【注意事项】1.准确掌握酶促反应的时间。2.若上清液的酶活性高,超过了校正曲线的范围,需要稀释后再测。(三)各上清液比活性分析按照下列公式计算各上清液的比活性和纯化倍数。纯化倍数一原酶多(离酸比防能性比活性=最智胰器量(酶回收率(%)=原葡要(最旁((想体×100蛋白质回收率(%)=原附表上比要方服智食是《量(性超体标)×100比活性是指每毫克蛋白质所具有的酶活性,用酶单位/毫克蛋白质表示。比活性越高,每单位重量酶蛋白的催化能力越强,表示酶制剂越纯。通过计算各纯化步骤中蛋白质、酶的回收率(得率),可了解各步骤蛋白质与酶的提取和丢失情况,从而获得整个分离提纯过程的总得率。理想的分离纯化效果应是在分离纯化的各步中,随着各步的进行,酶的比活性越来越高,酶的纯化倍数越来越高,杂蛋白越来越少而酶的得率较高。将各项数据添入下表中,并予以讨论。分部总体积蛋白质总蛋白酶活性总酶活性总酶回收比活性纯化总蛋白(ml) 回收(%)(mg/ml)(mg)(nmol/m)(nmol/min(%)(nmol/mg)倍数总体积)min)上清液1上清液IⅡ上清液IⅢI上清液IV上清液V实验16酸性磷酸酶时间进程曲线8
8 其中,酶促反应的时间为 15min,酶促反应中所用的上清液体积为 0.1ml。 ACP 活性单位的定义:在本实验条件下每分钟每毫升酶液产生 1nmol 酚(nmol/ml·min) 为一个活性单位。 【注意事项】 1.准确掌握酶促反应的时间。 2.若上清液的酶活性高,超过了校正曲线的范围,需要稀释后再测。 (三) 各上清液比活性分析 按照下列公式计算各上清液的比活性和纯化倍数。 原酶液 上清液 的比活性 纯化倍数= 各上清液的比活性 ( I) 蛋白质含量( ) 比活性 酶活性 酶液 mg U /ml = 100 min min = 原酶液(上清液 )总酶活力( / 总体积) 酶回收率(%) 各上清液总酶活力( / 总体积) I nmol nmol 100 / / = 原酶液(上清液 )蛋白质总含量( 总体积) 蛋白质回收率(%) 各上清液蛋白质总含量 ( 总体积) I mg mg 比活性是指每毫克蛋白质所具有的酶活性,用酶单位/毫克蛋白质表示。比活性越高,每 单位重量酶蛋白的催化能力越强,表示酶制剂越纯。 通过计算各纯化步骤中蛋白质、酶的回收率(得率),可了解各步骤蛋白质与酶的提取和 丢失情况,从而获得整个分离提纯过程的总得率。理想的分离纯化效果应是在分离纯化的各 步中,随着各步的进行,酶的比活性越来越高,酶的纯化倍数越来越高,杂蛋白越来越少, 而酶的得率较高。 将各项数据添入下表中,并予以讨论。 分部 总体积 (ml) 蛋白质 (mg/ml) 总蛋白 (mg) 总蛋白 回收(%) 酶活性 (nmol/ml · min) 总酶活性 (nmol/min· 总体积) 总酶回收 (%) 比活性 (nmol/mg) 纯化 倍数 上清液Ⅰ 上清液Ⅱ 上清液Ⅲ 上清液Ⅳ 上清液Ⅴ 实验 16 酸性磷酸酶时间进程曲线
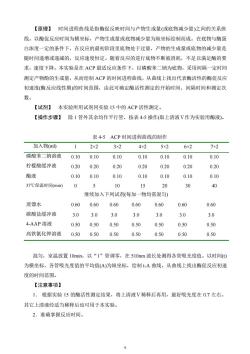
【原理】时间进程曲线是指酶促反映时间与产物生成量(或底物减少量)之间的关系曲线。以酶促反应时间为横坐标,产物生成量或底物减少量为纵坐标绘制而成。在底物与酶蛋白浓度一定的条件下,在反应的最初阶段里底物处于过量,产物的生成量或底物的减少量是随时间递增或递减的,反应速度恒定。随着反应的进行底物不断被消耗,不足以满足酶的要求,速度下降。本实验是在ACP最适反应条件下,以磷酸苯二钠为底物,采用间隔一定时间测定产物酚的生成量,从而绘制ACP的时间进程曲线,从曲线上找出代表酶活性的酶促反应初速度(酶反应线性期)的时间范围,由此可确定酶活性测定的开始时间、间隔时间和测定次数。【试剂】本实验所用试剂同实验15中的ACP活性测定。除1管外其余均作平行管,按表4-5 操作(取上清液V作为实验用酶液)。【操作步骤】表4-5ACP时间进程曲线的制作加入物(ml)2x23x24x25x26x27×21磷酸苯二钠溶液0.100.100.100.100.100.100.10柠檬酸缓冲液0.200.200.200.200.200.200.20酶液0.100.100.100.100.100.100.1037℃保温时间(min)S10152030400继续加入下列试剂(每加一物均需混匀)蒸馏水0.600.600.600.600.600.600.60碳酸盐缓冲液3.03.03.03.03.03.03.04-AAP溶液0.500.500.500.500.500.500.50高铁氰化钾溶液0.500.500.500.500.500.500.50混匀,室温放置10min,以“1”管调零,在510m波长处测得各管吸光度值。以时间(t)为横坐标,各管吸光度值的平均值(A)为纵坐标,绘制t-A曲线,从曲线上找出酶促反应初速度的时间范围。【注意事项】1.根据实验15的酶活性测定结果,将上清液V稀释后再用,最好吸光度在0.7左右,其它上清液经适当稀释后也可用于本实验2.准确掌握反应时间
9 【原理】 时间进程曲线是指酶促反映时间与产物生成量(或底物减少量)之间的关系曲 线。以酶促反应时间为横坐标,产物生成量或底物减少量为纵坐标绘制而成。在底物与酶蛋 白浓度一定的条件下,在反应的最初阶段里底物处于过量,产物的生成量或底物的减少量是 随时间递增或递减的,反应速度恒定。随着反应的进行底物不断被消耗,不足以满足酶的要 求,速度下降。本实验是在 ACP 最适反应条件下,以磷酸苯二钠为底物,采用间隔一定时间 测定产物酚的生成量,从而绘制 ACP 的时间进程曲线,从曲线上找出代表酶活性的酶促反应 初速度(酶反应线性期)的时间范围,由此可确定酶活性测定的开始时间、间隔时间和测定次 数。 【试剂】 本实验所用试剂同实验 15 中的 ACP 活性测定。 【操作步骤】 除 1 管外其余均作平行管,按表 4-5 操作(取上清液Ⅴ作为实验用酶液)。 表 4-5 ACP 时间进程曲线的制作 加入物(ml) 1 2×2 3×2 4×2 5×2 6×2 7×2 磷酸苯二钠溶液 0.10 0.10 0.10 0.10 0.10 0.10 0.10 柠檬酸缓冲液 0.20 0.20 0.20 0.20 0.20 0.20 0.20 酶液 0.10 0.10 0.10 0.10 0.10 0.10 0.10 37℃保温时间(min) 0 5 10 15 20 30 40 继续加入下列试剂(每加一物均需混匀) 蒸馏水 0.60 0.60 0.60 0.60 0.60 0.60 0.60 碳酸盐缓冲液 3.0 3.0 3.0 3.0 3.0 3.0 3.0 4-AAP 溶液 0.50 0.50 0.50 0.50 0.50 0.50 0.50 高铁氰化钾溶液 0.50 0.50 0.50 0.50 0.50 0.50 0.50 混匀,室温放置 10min,以“1”管调零,在 510nm 波长处测得各管吸光度值。以时间(t) 为横坐标,各管吸光度值的平均值(A)为纵坐标,绘制 t-A 曲线,从曲线上找出酶促反应初速 度的时间范围。 【注意事项】 1. 根据实验 15 的酶活性测定结果,将上清液Ⅴ稀释后再用,最好吸光度在 0.7 左右。 其它上清液经适当稀释后也可用于本实验。 2.准确掌握反应时间

实验17酸性磷酸酶酶浓度-速度曲线【原理】在酶促反应中,如果底物浓度[S]足以使酶完全饱和,则反应速度V与酶浓度[E]成正比。但在实际工作中,[S]是一定的,在酶蛋白浓度较低时,底物相对饱和,随[E]的升高,V不断加快,[E]-V曲线呈直线。随着酶浓度的不断增大,底物逐渐相对减少,不足以满足酶的需求,表现为V下降。因此,在酶活性的测定中,酶蛋白的浓度需要选择在酶促反应呈直线的范围内。【试剂】本实验所用试剂同ACP活性测定【操作步骤】除第1管外其余各管均作平行管,按表4-6(取上清液V作为实验用酶液)。表4-6ACP酶浓度-速度曲线的制作加入物(ml)2x23x24x25x26x2一磷酸苯二钠溶液0.400.400.400.400.400.40柠檬酸缓冲液1.601.501.401.301.201.10酶液00.100.200.300.400.5037℃水浴15min上述反应液0.500.500.500.500.500.50蒸馏水0.500.500.500.500.500.50碳酸盐缓冲液3.03.03.03.03.03.0 4-AAP溶液0.500.500.500.500.500.50高铁氰化钾溶液0.500.500.500.500.500.50混匀后,室温放置10min,以“1”管调零,在510nm处读取各管吸光度值。以蛋白质含量(μg)为横坐标,各管吸光度值平均值(A)为纵坐标绘制[E}-A曲线,求出呈直线的A值范围。【注意事项】1.根据实验15活性测定结果,将上清液V稀释后再用。2.本实验的目的是找出酶促反应呈直线的酶浓度线性范围,以指导后续实验的酶液用量因此需要准确吸取酶液。实验18pH-酸性磷酸酶活性曲线10
10 实验 17 酸性磷酸酶酶浓度-速度曲线 【原理】 在酶促反应中,如果底物浓度[S]足以使酶完全饱和,则反应速度 V 与酶浓度 [E]成正比。但在实际工作中,[S]是一定的,在酶蛋白浓度较低时,底物相对饱和,随[E]的 升高,V 不断加快,[E]-V 曲线呈直线。随着酶浓度的不断增大,底物逐渐相对减少,不足以 满足酶的需求,表现为 V 下降。因此,在酶活性的测定中,酶蛋白的浓度需要选择在酶促反 应呈直线的范围内。 【试剂】 本实验所用试剂同 ACP 活性测定 【操作步骤】 除第 1 管外其余各管均作平行管,按表 4-6(取上清液Ⅴ作为实验用酶液)。 表 4-6 ACP 酶浓度-速度曲线的制作 加入物(ml) 1 2×2 3×2 4×2 5×2 6×2 磷酸苯二钠溶液 0.40 0.40 0.40 0.40 0.40 0.40 柠檬酸缓冲液 1.60 1.50 1.40 1.30 1.20 1.10 酶液 0 0.10 0.20 0.30 0.40 0.50 37℃水浴 15min 上述反应液 0.50 0.50 0.50 0.50 0.50 0.50 蒸馏水 0.50 0.50 0.50 0.50 0.50 0.50 碳酸盐缓冲液 3.0 3.0 3.0 3.0 3.0 3.0 4-AAP 溶液 0.50 0.50 0.50 0.50 0.50 0.50 高铁氰化钾溶液 0.50 0.50 0.50 0.50 0.50 0.50 混匀后,室温放置 10min,以“1”管调零,在 510nm 处读取各管吸光度值。以蛋白质 含量(μg)为横坐标,各管吸光度值平均值(A)为纵坐标绘制[E]-A 曲线,求出呈直线的 A 值范 围。 【注意事项】 1.根据实验 15 活性测定结果,将上清液Ⅴ稀释后再用。 2.本实验的目的是找出酶促反应呈直线的酶浓度线性范围,以指导后续实验的酶液用量, 因此需要准确吸取酶液。 实验 18 pH-酸性磷酸酶活性曲线
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《临床生物化学》课程教学资源(实验指导)第3章 电泳技术.doc
- 《临床生物化学》课程教学资源(实验指导)第2章 层析技术.doc
- 《临床生物化学》课程教学资源(实验指导)第1章 光谱技术.doc
- 《临床生物化学》课程教学资源(作业习题)第十九章 自动临床生物化学分析仪的应用及评价(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十九章 自动临床生物化学分析仪的应用及评价(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十八章 治疗药物浓度监测(TDM)(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十八章 治疗药物浓度监测(TDM)(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十七章 妊娠的生物化学检验(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十七章 妊娠的生物化学检验(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十六章 肿瘤的生物化学检验(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十六章 肿瘤的生物化学检验(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十五章 神经系统疾病的生物化学检验(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十五章 神经系统疾病的生物化学检验(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十四章 模拟试题(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十四章 模拟试题(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十三章内分泌疾病的生物化学检验(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十三章 内分泌疾病的生物化学检验(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十二章 心血管系统疾病的生物化学检验试题(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十二章 心血管系统疾病的生物化学检验试题(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十一章 肾脏疾病的生物化学诊断(答案).pdf
- 《临床生物化学》课程教学资源(实验指导)第5章 分子生物学实验技术.doc
- 《临床生物化学》课程教学资源(实验指导)第6章 方法学评价与试剂盒评价实验.doc
- 《临床生物化学》课程教学资源(实验指导)第7章 血清(浆)蛋白质测定.doc
- 《临床生物化学》课程教学资源(实验指导)第9章 血清(浆)脂类及脂蛋白测定.doc
- 《临床生物化学》课程教学资源(实验指导)第10章 无机离子及微量元素测定.doc
- 《临床生物化学》课程教学资源(实验指导)第11章 血气分析.doc
- 《临床生物化学》课程教学资源(实验指导)第13章 非蛋白含氮化合物及总胆汁酸测定.doc
- 《临床生物化学》课程教学资源(实验指导)第14章 常用酶类测定.doc
- 《临床生物化学》课程教学资源(实验指导)第15章 常用治疗性药物监测.doc
- 《临床生物化学》课程教学资源(实验指导)第16章 肿瘤标志物的测定.doc
- 《临床生物化学》课程教学资源(实验指导)第17章 神经递质与其他活性物质的测定.doc
- 《临床生物化学》课程教学资源(实验指导)第18章 临床化学实验室基础.doc
- 《临床生物化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 《临床生物化学》课程教学资源(PPT课件)第二章 生物化学检验中的诊断酶学.ppt
- 《临床生物化学》课程教学资源(PPT课件)第三章 血浆蛋白质与含氮化合物的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第四章 糖代谢紊乱的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第五章 血浆脂蛋白代谢紊乱的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第六章 电解质和酸碱平衡紊乱的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第七章 骨代谢紊乱及相关元素的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第八章 微量元素与维生素异常的生物化学检验.ppt
