《临床生物化学》课程教学资源(实验指导)第16章 肿瘤标志物的测定

第十六章肿瘤标志物的测定肿瘤标志物(tumormarkers,TM)是指在肿瘤发生过程中,由肿瘤组织产生、释放;或者是机体对癌类反应性的一类物质。目前主要是对 TM 中的肿瘤相关抗原(tumor amociatedantigen,TAA)进行检测。检测TM主要方法是酶免疫测定方法(EIA)、放射免疫分析方法(RIA)和化学发光法(CL)。EIA的灵敏度可与RIA相比,而且酶标记物的保存期可长达两年以上,无放射性污染,使用较为安全,而CL具有更高的灵敏性。实验117放射免疫(双抗体)法测定甲胎蛋白甲胎蛋白(AFP)为胎盘的重要血清成分,由卵黄囊肝细胞合成。胎儿出生后急剧下降,在数月至一年内下降至正常水平(<20ng/ml)。成人再现 AFP升高则提示肝细胞癌或生殖腺胚胎癌。此外,妊娠、肝病活动期,以及与胚肝、卵黄囊、胚胎胃肠道有关的少数良性疾病AFP亦可有不同程度升高。AFP对肝细胞癌诊断的临床意义可归纳为:①为各种诊断方法中专一性仅次于病理检查的诊断方法;②为目前最好的早期诊断方法,可在症状出现前6~12月作出诊断;③为反映病情变化核治疗效果的敏感指标;有助于检出亚临床复发与转移。【原理】本方法是样品中的AFP与加入标记的125I-AFP后,再加入有限量的专一性AFP抗体(Ab)与样品中AFP及1251-AFP发生竞争性结合反应。在此反应体系中,当1251-AFP和Ab的量保持恒定,则1251-AFP-Ab复合物的形成量与非标记的AFP含量之间呈现一种逆相关函数关系,即样品中AFP含量高时,AFP对专一性Ab的结合能力强,1251-AFP-Ab复合物生成量就减少;反之,当样品中AFP含量低时,1251-AFP-Ab复合物生成量就多。在反应达到平衡时,再用第二抗体沉淀复合物,离心分离,测定沉淀物的放射性(B)和总放射性(T),计算各标准管的结合率(B/T),作出剂量反应曲线(或称标准曲线)。根据样品的结合率即可从剂量反应曲线上查得样品中AFP的浓度。【试剂】马抗AFP血清(第一抗体)。12.羊抗马IgG血清(第二抗体)。3.缓冲液:配制含2%正常马血清的0.01mol/LPBS(pH7.4)4.1251-AFP:使用时稀释成10000~12000cpm/0.1ml5.AFP标准液:配制其浓度分别为0、20、50、100、200、400ng/ml的标准液6.正常人血清及受检人血清。第1页共18页
第 1 页 共 18 页 第十六章 肿瘤标志物的测定 肿瘤标志物(tumor markers,TM)是指在肿瘤发生过程中,由肿瘤组织产生、释放;或者 是机体对癌类反应性的一类物质。目前主要是对 TM 中的肿瘤相关抗原(tumor amociated antigen,TAA)进行检测。检测 TM 主要方法是酶免疫测定方法(EIA)、放射免疫分析方法(RIA) 和化学发光法(CL)。EIA 的灵敏度可与 RIA 相比,而且酶标记物的保存期可长达两年以上, 无放射性污染,使用较为安全,而 CL 具有更高的灵敏性。 实验 117 放射免疫(双抗体)法测定甲胎蛋白 甲胎蛋白(AFP)为胎盘的重要血清成分,由卵黄囊肝细胞合成。胎儿出生后急剧下降, 在数月至一年内下降至正常水平(<20ng/ml)。成人再现 AFP 升高则提示肝细胞癌或生殖腺胚 胎癌。此外,妊娠、肝病活动期,以及与胚肝、卵黄囊、胚胎胃肠道有关的少数良性疾病 AFP 亦可有不同程度升高。AFP 对肝细胞癌诊断的临床意义可归纳为:①为各种诊断方法中 专一性仅次于病理检查的诊断方法;②为目前最好的早期诊断方法,可在症状出现前 6~12 月作出诊断;③为反映病情变化核治疗效果的敏感指标;④有助于检出亚临床复发与转移。 【原理】 本方法是样品中的 AFP 与加入标记的 125I-AFP 后,再加入有限量的专一性 AFP 抗体(Ab)与样品中 AFP 及 125I-AFP 发生竞争性结合反应。在此反应体系中,当 125I-AFP 和 Ab 的量保持恒定,则 125I-AFP-Ab 复合物的形成量与非标记的 AFP 含量之间呈现一种逆 相关函数关系,即样品中 AFP 含量高时,AFP 对专一性 Ab 的结合能力强,125I-AFP-Ab 复 合物生成量就减少;反之,当样品中 AFP 含量低时, 125I-AFP-Ab 复合物生成量就多。在反 应达到平衡时,再用第二抗体沉淀复合物,离心分离,测定沉淀物的放射性(B)和总放射性(T), 计算各标准管的结合率(B/T),作出剂量反应曲线(或称标准曲线)。根据样品的结合率即可从 剂量反应曲线上查得样品中 AFP 的浓度。 【试剂】 1.马抗 AFP 血清(第一抗体)。 2.羊抗马 IgG 血清(第二抗体)。 3.缓冲液: 配制含 2%正常马血清的 0.01mol/LPBS(pH7.4)。 4.125I-AFP:使用时稀释成 10 000~12 000cpm/0.1ml。 5.AFP 标准液:配制其浓度分别为 0、20、50、100、200、400ng/ml 的标准液。 6.正常人血清及受检人血清
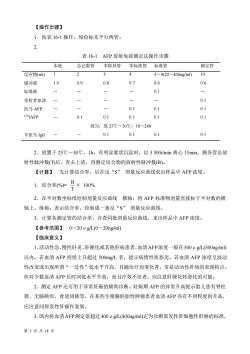
【操作步骤】1.按表16-1操作,每份标本平行两管。2表16-1AFP放射免疫测定法操作步骤本底总记数管非特异管零标准管标准管测定管反应物(ml)2345~9(20~400ng/ml)8---019---1.00.60.6缓冲液-0.1标准液/--0.1受检者血清-0.10.10.1抗马AFP0.1 0.10.10.11251AFP-0.1混匀,放25℃~30℃,18~24h0.1 -0.10.10.1 羊抗马 IgG2.放置于25℃~30℃,1h,有明显絮状沉淀时,以3500r/min离心15min,测各管总放射性脉冲数(T)后,弃去上清,再测定结合物的放射性脉冲数(B)。【计算】先计算结合率,后在反“s”剂量反应曲线求出样品中AFP浓度。1.结合率(%)=×100%2.在半对数坐标纸绘制剂量反应曲线横轴:将AFP标准物剂量直接标于半对数的横轴上。纵轴:表示结合率,绘制成一条反“s”剂量反应曲线。3.计算各测定管的结合率,并查同批剂量反应曲线,求出样品中AFP浓度。【参考范围】0~20 μg/L(0~20ng/ml)【临床意义】1.活动性急、慢性肝炎、肝硬化或其他肝病患者,血清AFP浓度一般在500ug/L(500ng/ml)以内。若血清AFP持续上升超过500mg/L者,提示病情性质恶劣。若血清AFP浓度呈波动性改变或出现所谓“一过性”低水平升高,且随治疗而变化者,常是活动性肝病的表现特点。但对少数血清AFP长时间低水平升高,而且疗效不佳者,应注意肝硬化转恶化的可能。2.测定AFP还可用于异常妊娠的辅助诊断。妊娠期AFP的异常升高提示胎儿患有脊柱裂、无脑畸形、食道闭锁等。在某些生殖腺胚胎性肿瘤患者血清 AFP亦有不同程度的升高,应注意同原发性肝癌作鉴别。3.国内将血清AFP测定值超过400 ug/L(400ng/ml)定为诊断原发性肝细胞性肝癌的标准第2页共18页
第 2 页 共 18 页 【操作步骤】 1.按表 16-1 操作,每份标本平行两管。 2. 表 16-1 AFP 放射免疫测定法操作步骤 本底 总记数管 非特异管 零标准管 标准管 测定管 反应物(ml) 1 2 3 4 5~9(20~400ng/ml) 10 缓冲液 1.0 0.9 0.8 0.7 0.6 0.6 标准液 - - - - 0.1 - 受检者血清 - - - - - 0.1 抗马 AFP - - - 0.1 0.1 0.1 125IAFP - 0.1 0.1 0.1 0.1 0.1 混匀,放 25℃~30℃,18~24h 羊抗马 IgG - - 0.1 0.1 0.1 0.1 2.放置于 25℃~30℃,1h,有明显絮状沉淀时,以 3 500r/min 离心 15min,测各管总放 射性脉冲数(T)后,弃去上清,再测定结合物的放射性脉冲数(B)。 【计算】 先计算结合率,后在反“S” 剂量反应曲线求出样品中 AFP 浓度。 1.结合率(%)= T B × 100% 2.在半对数坐标纸绘制剂量反应曲线 横轴:将 AFP 标准物剂量直接标于半对数的横 轴上。纵轴:表示结合率,绘制成一条反“S” 剂量反应曲线。 3.计算各测定管的结合率,并查同批剂量反应曲线,求出样品中 AFP 浓度。 【参考范围】 0~20μg/L(0~20ng/ml) 【临床意义】 1.活动性急、慢性肝炎、肝硬化或其他肝病患者,血清AFP浓度一般在500μg/L(500ng/ml) 以内。若血清 AFP 持续上升超过 500mg/L 者,提示病情性质恶劣。若血清 AFP 浓度呈波动 性改变或出现所谓“一过性”低水平升高,且随治疗而变化者,常是活动性肝病的表现特点。 但对少数血清 AFP 长时间低水平升高,而且疗效不佳者,应注意肝硬化转恶化的可能。 2.测定 AFP 还可用于异常妊娠的辅助诊断。妊娠期 AFP 的异常升高提示胎儿患有脊柱 裂、无脑畸形、食道闭锁等。在某些生殖腺胚胎性肿瘤患者血清 AFP 亦有不同程度的升高, 应注意同原发性肝癌作鉴别。 3.国内将血清AFP测定值超过400μg/L(400ng/ml)定为诊断原发性肝细胞性肝癌的标准

F但必须排除妊娠、新生儿或是活动期肝病及继发于其他脏器的肿瘤所引起的血清AFP升高【注意事项】1.各种试剂在2~8℃保存,严禁冰冻,尤其是1251-AFP标记物,血清样品可低温保存。高脂血会使结果偏高,故应空腹采血。严重溶血的标本不能用于测定。2.当加入第二抗原温育后,应出现明显的絮状沉淀。否则应延长温育时间,或追加第二抗体量,直到明显絮状物出现,才离心计数。3.制作量反应曲线时,AFP0ng/ml的脉冲数与AFP400ng/ml的脉冲数的比值要大于3.0若此比值过低,提示剂量反应曲线灵敏度低,准确性较差。附:免疫电泳自显影法测定甲胎蛋白异质体甲胎蛋白异质体是因合成组织的不同以及糖基化过程的差异而形成的糖链结构互不相同所致。分析异质体可以提高对肝癌诊断的专一性。【原理】将患者血清在含有扁豆凝集素(LCA)的琼脂凝胶中作第一向电泳,将AFP中的异质体条带分出;再加入1251标记的AFP在含有AFP抗体的基质中作垂直方向的第二向电泳,放射自显影以后,显示出第一向电泳析出条带在第二向电泳中所形成的相应的放射性峰,各峰覆盖的面积比率,可表示出异质体含量的比率。【试剂】1.巴比妥缓冲液0.02mol/L(pH8.6)。2.0.3%扁豆凝集素(LCA)溶液。3.2%刀豆素(ConA)溶液。4.1%琼脂糖溶液。5.1251标记AFP及抗AFP抗血清。【操作步骤】1.取5ml1%琼脂糖溶液,加入0.25ml0.3%LCA或2%ConA溶液,在6cm×10cm玻板一侧浇注2cm×10cm凝胶条,于阴极端加5~50u1待测血清,作第一向电泳,7V/cm,90min。2.吸取12ml1%琼脂糖液加0.12ml抗AFP抗血清灌注板的剩余部分。再在第一向电泳胶条内血清电泳行经的阴极侧切0.3cm×7em槽,以含5~10u11251AFP的琼脂糖液充填,作第二向电泳,并与第一向电泳垂直,2V/cm,18h。3.电泳结束,将凝胶板置80℃烘干,覆盖×线胶片,自行曝光48h,冲洗呈像。【计算】1.AFP异体体定量自显影后出现两个峰,距原点近的为凝集素结合型AFP,两峰面积之比即为异质体含量之百分比。2.结果判别LCA非结合型AFP<75%作为肝癌诊断标准。第3页共18页
第 3 页 共 18 页 但必须排除妊娠、新生儿或是活动期肝病及继发于其他脏器的肿瘤所引起的血清 AFP 升高。 【注意事项】 1.各种试剂在 2~8℃保存,严禁冰冻,尤其是 125I-AFP 标记物,血清样品可低温保存。 高脂血会使结果偏高,故应空腹采血。严重溶血的标本不能用于测定。 2.当加入第二抗原温育后,应出现明显的絮状沉淀。否则应延长温育时间,或追加第 二抗体量,直到明显絮状物出现,才离心计数。 3.制作量反应曲线时,AFP 0 ng/ml 的脉冲数与 AFP 400ng/ml 的脉冲数的比值要大于 3.0。 若此比值过低,提示剂量反应曲线灵敏度低,准确性较差。 附: 免疫电泳自显影法测定甲胎蛋白异质体 甲胎蛋白异质体是因合成组织的不同以及糖基化过程的差异而形成的糖链结构互不相同所致。分析异 质体可以提高对肝癌诊断的专一性。 【原理】 将患者血清在含有扁豆凝集素(LCA)的琼脂凝胶中作第一向电泳,将 AFP 中的异质体条带 分出;再加入 125I 标记的 AFP 在含有 AFP 抗体的基质中作垂直方向的第二向电泳,放射自显影以后,显 示出第一向电泳析出条带在第二向电泳中所形成的相应的放射性峰,各峰覆盖的面积比率,可表示出异质 体含量的比率。 【试剂】 1.巴比妥缓冲液 0.02mol/L(pH8.6)。 2.0.3%扁豆凝集素(LCA)溶液。 3.2%刀豆素(ConA)溶液。 4.1%琼脂糖溶液。 5.125I 标记 AFP 及抗 AFP 抗血清。 【操作步骤】 1.取 5ml 1%琼脂糖溶液,加入 0.25ml 0.3%LCA 或 2%ConA 溶液,在 6cm×10cm 玻板一侧浇注 2cm ×10cm 凝胶条,于阴极端加 5~50μl 待测血清,作第一向电泳,7V/cm,90min。 2.吸取 12ml 1%琼脂糖液加 0.12ml 抗 AFP 抗血清灌注板的剩余部分。再在第一向电泳胶条内血清电 泳行经的阴极侧切 0.3cm×7cm 槽,以含 5~10μl 125I AFP 的琼脂糖液充填,作第二向电泳,并与第一向电 泳垂直,2V/cm,18h。 3.电泳结束,将凝胶板置 80℃烘干,覆盖 X 线胶片,自行曝光 48h,冲洗呈像。 【计算】 1.AFP 异体体定量 自显影后出现两个峰,距原点近的为凝集素结合型 AFP,两峰面积之比即为异 质体含量之百分比。 2.结果判别 LCA 非结合型 AFP<75%作为肝癌诊断标准

【注意事项】1第一向电泳中AFP加样量选择首先做患者血清中AFP定量,若AFP<100ng/ml,加样50ul;AFP400ng/ml加样15~20ul;AFP1000ng/ml加样5~10ul。AFP浓度再高者则予以稀释后加样。2.在第一向凝胶条狭槽内加含 1251-AFP的琼脂量以达到与原凝胶厚度平齐或略少些为宜,不可溢出。电泳桥不得与碘标记物接触,并经常更换。3.本方法测定100例肝细胞癌,50例良性肝病。肝病组LCA非结合型AFP平均占93.4±7.9%;肝癌组LCA非结合型AFP平均为48.5%±30.4%。肝癌阳性检出率为84%。实验 118 ELISA 法测定癌胚抗原(CEA)自1965年Gold等首先从人结肠组织发现一种蛋白质,因这种抗原也在胎儿肠道中发现因而称为癌胚抗原(cancino embryoniv antigen,CEA)。CEA属于非器官特异性肿瘤相关抗原,分泌CEA的肿瘤大多位于空腔脏器,如胃肠道、呼吸道、泌尿道等。CEA经胃肠道代谢,而肿瘤状态时CEA进入血和淋巴循环,引起血清CEA异常升高。在结肠癌检测中CEA是最常用的肿瘤标志物,但对于病变限于肠壁以内者却极少出现CEA升高,故CEA很难对结肠癌作早期诊断。80年代陆续发现了CA19-9和CA242,它们的最大临床价值是对胰腺癌的检测,但也经常把这两种标志物与CEA合用,以提高结直肠癌的诊断和治疗水平。其中以CEA为首选的标志物。利用双抗体夹心技术,将抗CEA的单克隆抗体包被于聚苯乙烯塑料珠上,【原理】制成固相抗体珠,用此珠去吸附样品中的CEA,充分洗涤后再依次与酶标记CEA抗体与底物反应,以成色后的吸光度值从剂量反应曲线查得样品中的CEA含量。【试剂】1.CEA标准液:用纯化CEA配制为浓度分别为0、1.5、3.0、10.0、20.0ng/ml系列标准液。2.CEA抽提液:0.2mol/L醋酸钠缓冲液(pH5.0)。3.基质应用液:取邻苯二胺80mg溶于pH5.0磷酸-枸橡酸缓冲液50ml中,56℃水浴中促溶。完全溶后加入新鲜的30%H20220u1,混匀。此基质液呈无色透明液体,若显黄色不能使用。将此底物液储于棕色瓶中,30min内用完。4.辣根过氧化物酶(HRP)标记的抗 CEA 抗体。5. 洗涤液:0.05mol/L PBS (pH 7.40)-0.1% Tween-20。6.抗CEA单克隆抗体包被的圆珠。7. 待检血样:血清(浆)。第4页共18页
第 4 页 共 18 页 【注意事项】 1.第一向电泳中 AFP 加样量选择 首先做患者血清中 AFP 定量,若 AFP<l00ng/ml,加样 50μl; AFP 400ng/ml 加样 15~20μl;AFP 1 000ng/ml 加样 5~10μl。AFP 浓度再高者则予以稀释后加样。 2.在第一向凝胶条狭槽内加含 125I-AFP 的琼脂量以达到与原凝胶厚度平齐或略少些为宜,不可溢出。 电泳桥不得与碘标记物接触,并经常更换。 3.本方法测定 100 例肝细胞癌,50 例良性肝病。肝病组 LCA 非结合型 AFP 平均占 93.4±7.9%;肝 癌组 LCA 非结合型 AFP 平均为 48.5%±30.4%。肝癌阳性检出率为 84%。 实验 118 ELISA 法测定癌胚抗原(CEA) 自 1965 年 Gold 等首先从人结肠组织发现一种蛋白质,因这种抗原也在胎儿肠道中发现, 因而称为癌胚抗原(cancino embryoniv antigen,CEA)。CEA 属于非器官特异性肿瘤相关抗 原,分泌 CEA 的肿瘤大多位于空腔脏器,如胃肠道、呼吸道、泌尿道等。CEA 经胃肠道代 谢,而肿瘤状态时 CEA 进入血和淋巴循环,引起血清 CEA 异常升高。在结肠癌检测中 CEA 是最常用的肿瘤标志物,但对于病变限于肠壁以内者却极少出现 CEA 升高,故 CEA 很难对 结肠癌作早期诊断。80 年代陆续发现了 CA19-9 和 CA242,它们的最大临床价值是对胰腺癌的 检测,但也经常把这两种标志物与 CEA 合用,以提高结直肠癌的诊断和治疗水平。其中以 CEA 为首选的标志物。 【原理】 利用双抗体夹心技术,将抗 CEA 的单克隆抗体包被于聚苯乙烯塑料珠上, 制成固相抗体珠,用此珠去吸附样品中的 CEA,充分洗涤后再依次与酶标记 CEA 抗体与底 物反应,以成色后的吸光度值从剂量反应曲线查得样品中的 CEA 含量。 【试剂】 1.CEA 标准液:用纯化 CEA 配制为浓度分别为 0、1.5、3.0、10.0、20.0ng/ml 系列标准 液。 2.CEA 抽提液:0.2mol/L 醋酸钠缓冲液(pH5.0)。 3.基质应用液:取邻苯二胺 80mg 溶于 pH5.0 磷酸-枸椽酸缓冲液 50ml 中,56℃水浴中促 溶。完全溶后加入新鲜的 30%H2O2 20μ1,混匀。此基质液呈无色透明液体,若显黄色不能 使用。将此底物液储于棕色瓶中,30min 内用完。 4.辣根过氧化物酶(HRP)标记的抗 CEA 抗体。 5.洗涤液:0.05mol/L PBS (pH 7.40)-0.1% Tween-20。 6.抗 CEA 单克隆抗体包被的圆珠。 7.待检血样:血清(浆)

【操作步骤】1.待检抗原的制备:取待检血清或血浆0.5ml,加0.2mol/L醋酸钠缓冲液(pH5.0)1.0ml,混匀后于70℃水浴内15min。以3000r/min离心10min。取上清液作为3倍稀释的待检抗原阳性对照品必须同步处理。2.在20孔反应板上每孔中加入上述(第一步操作)待检抗原0.2ml。同时加入CEA标准抗原及阳性对照抗原。每份样品均作平行两孔3.用镊子夹起CEA固相抗体珠,甩掉附着的液体后投入孔内。反应板上覆盖一张干净纸,将板漂浮于37℃水浴中反应2h。注意勿盖水箱盖,反应完成后可连续操作或置4℃过夜4.用PBS-Tween-20洗涤液洗涤3次。每次加入洗涤液后放置3min再抽净(负压抽吸)洗液。最后一次洗液放入后静置至准备加酶标记抗CEA之前时再抽净。5.二抗液制备取每支冻干的酶标记抗CEA抗体用蒸馏水1.0ml溶解。因冻干时加有明胶保护剂,溶解时须放置37℃水浴中1min。待充分溶解后再按要求稀释至最适工作浓度。6.将孔中洗涤液抽净,每孔加入酶标记抗CEA工作液0.2ml,将反应板用干净纸覆盖后再漂浮于37℃水浴中反应2h。勿盖水箱盖。7.用PBS-Tween-20洗液洗涤4~5次。末次洗液放入后静置至加基质液前。8.将孔中洗液抽净,把反应板与装有75mm×12mm试管的20孔纸盒按编号对好位置,翻转反应板使扣在纸盒上,将圆珠对号移入纸盒上的试管中,每管加入新鲜配制的底物应用液0.3ml。另取一支干净试管加基质应用液0.3ml,供测定吸光度时调零使用。避光,室温中反应30min。9.每管加入1mol/LHC12.0ml终止反应。10.于492nm波长处,1.0cm比色血用空白管调零,测定吸光度(应于终止反应1h内完成)。【计算】·求出各平行管的吸光度均值。2.绘制剂量反应曲线以各标准抗原吸光度均值为Y轴,标准抗原的CEA浓度为X轴于普通坐标纸上绘制剂量反应曲线。3.将样品吸光度于剂量反应曲线上查得CEA浓度,再乘以稀释倍数3,即得出样品中CEA浓度。【参考范围】正常成人(96%~97%)血清CEA含量2.5ug/L(>2.5ng/ml),有的甚至>5μg/L(>5ng/ml)。第5页共18页
第 5 页 共 18 页 【操作步骤】 1.待检抗原的制备 取待检血清或血浆 0.5ml,加 0.2mol/L 醋酸钠缓冲液(pH5.0)1.0ml, 混匀后于 70℃水浴内 15min。以 3 000r/min 离心 10min。取上清液作为 3 倍稀释的待检抗原。 阳性对照品必须同步处理。 2.在 20 孔反应板上每孔中加入上述(第一步操作)待检抗原 0.2ml。同时加入 CEA 标准 抗原及阳性对照抗原。每份样品均作平行两孔。 3.用镊子夹起 CEA 固相抗体珠,甩掉附着的液体后投入孔内。反应板上覆盖一张干净 纸,将板漂浮于 37℃水浴中反应 2h。注意勿盖水箱盖,反应完成后可连续操作或置 4℃过夜。 4.用 PBS-Tween-20 洗涤液洗涤 3 次。每次加入洗涤液后放置 3min 再抽净(负压抽吸)洗 液。最后一次洗液放入后静置至准备加酶标记抗 CEA 之前时再抽净。 5.二抗液制备 取每支冻干的酶标记抗 CEA 抗体用蒸馏水 1.0ml 溶解。因冻干时加有 明胶保护剂,溶解时须放置 37℃水浴中 1min。待充分溶解后再按要求稀释至最适工作浓度。 6.将孔中洗涤液抽净,每孔加入酶标记抗 CEA 工作液 0.2ml,将反应板用干净纸覆盖后 再漂浮于 37℃水浴中反应 2h。勿盖水箱盖。 7.用 PBS-Tween-20 洗液洗涤 4~5 次。末次洗液放入后静置至加基质液前。 8.将孔中洗液抽净,把反应板与装有 75mm×12mm 试管的 20 孔纸盒按编号对好位置, 翻转反应板使扣在纸盒上,将圆珠对号移入纸盒上的试管中,每管加入新鲜配制的底物应用 液 0.3ml。另取一支干净试管加基质应用液 0.3ml,供测定吸光度时调零使用。避光,室温中 反应 30min。 9.每管加入 1mol/L HCl 2.0ml 终止反应。 10.于 492nm 波长处,1.0cm 比色皿用空白管调零,测定吸光度(应于终止反应 1h 内完 成)。 【计算】 1.求出各平行管的吸光度均值。 2.绘制剂量反应曲线以各标准抗原吸光度均值为 Y 轴,标准抗原的 CEA 浓度为 X 轴, 于普通坐标纸上绘制剂量反应曲线。 3.将样品吸光度于剂量反应曲线上查得 CEA 浓度,再乘以稀释倍数 3,即得出样品中 CEA 浓度。 【参考范围】 正常成人(96%~97%)血清 CEA 含量<2.5μg/L(<2.0ng/ml); 大量吸烟者(20%~40%)>2.5μg/L(>2.5ng/ml),有的甚至>5μg/L(>5ng/ml)

【注意事项】由于CEA提纯和单克隆抗体制备的技术很复杂,目前临床上多购买厂家生产的试剂盒进行测定。不同厂家生产的CEA诊断试剂,由于方法学及抗血清特异性的差异,测定值可能会有差别。不同批号的试剂严禁混合使用。试剂盒应4℃存放,并避免强光照射。2.20孔反应板及试管使用后,反应板可用洗板机清洗;也可用水洗净,后浸泡于硫酸铬酸洗液中,再经自来水、蒸馏水冲洗干净,干燥后可再次使用。3.基质液配制与使用过程中,禁与金属物品或其他氧化物接触。不得使用塑料容器。4.受检血清应新鲜,避免反复冻融。【临床意义】1.测定胃液和睡液的CEA对胃癌的诊断较有意义。胃液中的CEA含量一般高于血清中含量的1.5~15.5倍,而且较血中CEA升高较早。如果血中CEA在高水平上波动,而胃血CEA比值>1,则有利于胃癌的诊断,预后不良。唾液中的CEA更高于胃液,睡液CEA显著升高时与胃癌诊断的符合率高达90%。2.CEA是各脏器癌的广谱肿瘤标记,特异差,无助于各种肿瘤的早期诊断。但有助于鉴别肿瘤的良性和恶性。CEA测定可作为肿瘤手术成败的检测指标,对肿瘤的复发、转移及预后判断有一定的价值。3.高浓度的血清CEA含量与结肠癌相关,但无早期诊断价值。CEA升高也见于肠梗阻胆道梗阻、尿毒症、胰腺炎、肝硬化、结肠或直肠息肉、溃疡性结肠炎、局限性肠炎和溃疡病。附:放射免疫法测定癌胚抗原利用均相竞争性抑制原理,采用非饱和(顺序饱和)法对病人血清、血浆、胸水、腹水以及【原理】其它体液进行直接测定。样品中的CEA与限量的抗体预先反应一段时间,然后加入1251-CEA参与竞争剩余的抗体结合位。当样品的CEA浓度高时,剩余的抗体结合位就少,从而与抗体结合的1251-CEA就少。用分离剂分离出抗原-抗体复合物,并测定结合物中的放射性,发现1251-CEA的结合量与样品的CEA浓度呈函数关系。把标准点的数据绘成函数曲线后,便可算出检样中的CEA浓度。【试剂】有成套商品试剂盒供应。1.CEA标准品有0、5、10、20、40、80ng/ml共6种标准冻干品,使用时用蒸馏水1.0ml溶解2.1251-CEA冻干品,使用时用蒸馏水10ml溶解。3.抗CEA冻干品使用时用蒸馏水溶解(参照试剂说明书)。4.分离剂摇匀后直接使用。5所用试剂溶解后4℃保存,有效期2周。不允许不同批试剂相互替用。第6页共18页
第 6 页 共 18 页 【注意事项】 1.由于 CEA 提纯和单克隆抗体制备的技术很复杂,目前临床上多购买厂家生产的试剂 盒进行测定。不同厂家生产的 CEA 诊断试剂,由于方法学及抗血清特异性的差异,测定值 可能会有差别。不同批号的试剂严禁混合使用。试剂盒应 4℃存放,并避免强光照射。 2.20 孔反应板及试管使用后,反应板可用洗板机清洗;也可用水洗净,后浸泡于硫酸- 铬酸洗液中,再经自来水、蒸馏水冲洗干净,干燥后可再次使用。 3.基质液配制与使用过程中,禁与金属物品或其他氧化物接触。不得使用塑料容器。 4.受检血清应新鲜,避免反复冻融。 【临床意义】 1.测定胃液和唾液的 CEA 对胃癌的诊断较有意义。胃液中的 CEA 含量一般高于血清中 含量的 1.5~15.5 倍,而且较血中 CEA 升高较早。如果血中 CEA 在高水平上波动,而胃血 CEA 比值>1,则有利于胃癌的诊断,预后不良。唾液中的 CEA 更高于胃液,唾液 CEA 显著 升高时与胃癌诊断的符合率高达 90%。 2.CEA 是各脏器癌的广谱肿瘤标记,特异差,无助于各种肿瘤的早期诊断。但有助于 鉴别肿瘤的良性和恶性。CEA 测定可作为肿瘤手术成败的检测指标,对肿瘤的复发、转移及 预后判断有一定的价值。 3.高浓度的血清 CEA 含量与结肠癌相关,但无早期诊断价值。CEA 升高也见于肠梗阻、 胆道梗阻、尿毒症、胰腺炎、肝硬化、结肠或直肠息肉、溃疡性结肠炎、局限性肠炎和溃疡 病。 附:放射免疫法测定癌胚抗原 【原理】 利用均相竞争性抑制原理,采用非饱和(顺序饱和)法对病人血清、血浆、胸水、腹水以及 其它体液进行直接测定。样品中的 CEA 与限量的抗体预先反应一段时间,然后加入 125I-CEA 参与竞争剩 余的抗体结合位。当样品的 CEA 浓度高时,剩余的抗体结合位就少,从而与抗体结合的 125I-CEA 就少。 用分离剂分离出抗原-抗体复合物,并测定结合物中的放射性,发现 125I-CEA 的结合量与样品的 CEA 浓度 呈函数关系。把标准点的数据绘成函数曲线后,便可算出检样中的 CEA 浓度。 【试剂】 有成套商品试剂盒供应。 1.CEA 标准品 有 0、5、10、20、40、80ng/ml 共 6 种标准冻干品,使用时用蒸馏水 1.0ml 溶解。 2.125I-CEA 冻干品,使用时用蒸馏水 10ml 溶解。 3.抗 CEA 冻干品 使用时用蒸馏水溶解(参照试剂说明书)。 4.分离剂 摇匀后直接使用。 5.所用试剂溶解后 4℃保存,有效期 2 周。不允许不同批试剂相互替用

【样品处理】溶血和脂血样品不能使用,混浊样品离心后取上清。隔日测定的样品应一20℃保存,并不得反复冻融。测定尿液时,应取样品50uI另加0ng/ml标准品50u1稀释。高浓度血清样品(CEA>30ng/ml)应先用生理盐水稀释,然后与尿样相同的方法处理。计算结果时,要注意样品稀释倍数。胸、腹水可直接测定。(按试剂盒操作说明进行)【操作步骤】按表16-2加样,均作平行复管测定。1.2.表16-2放射免疫法测定CEA操作步骤加入物(μl)NSB管Bo管Bl-Bs管样品管1001000ng/ml标准品-100--5~80ng/ml标准品-100样品一100100抗CEA1100100蒸馏水摇匀,37℃2h121-CEA10100100100摇匀,4℃过夜,任选3管测放射性作为总T1000分离剂1000100010002.室温下放置15min,2000r/min,离心5min,弃上清,测定各管沉淀的放射性。【计算】1.计算各组反应管的复管平均计数率(cpm)。2.计算各组反应管的B/Bo(%)或B/I(%):沉淀物(cpm)-NSB(cpm)B / Bo(%) = ×100%零标准管沉淀(cpm)-NSB(cpm)沉淀物(cpm)-NSB(cpm)×10% B / T(%) =T管(cpm)-本底(cpm)注:本底cpm为无反应系统的cpm3.以CEA含量为横坐标(取半对数纸的对数边),各标准管测得的结合率(B/Bo%或B/T%)为纵坐标绘制校正竞争抑制曲线,据此可求出样品中CEA的含量。4.根据各样品管的B/Bo(%)或B/(%)值;从剂量反应曲线中算出CEA的含量,单位是gL。【参考范围】血清CEA<2.5μg/L(非吸烟者)【临床意义】1.恶性肿瘤的辅助诊断CEA 检测虽然对恶性肿瘤不是一项特异的肿瘤标志,但结合临床和其他检测项目,仍具有一定的临床意义。大量资料表明,恶性肿瘤患者中,血清CEA的测定有较高的阳性率,第7页共18页
第 7 页 共 18 页 【样品处理】 溶血和脂血样品不能使用,混浊样品离心后取上清。隔日测定的样品应-20℃保存, 并不得反复冻融。 测定尿液时,应取样品 50μl 另加 0ng/m1 标准品 50μl 稀释。高浓度血清样品(CEA>30ng/ml)应先用 生理盐水稀释,然后与尿样相同的方法处理。计算结果时,要注意样品稀释倍数。 胸、腹水可直接测定。 【操作步骤】 (按试剂盒操作说明进行) 1. 按表 16-2 加样,均作平行复管测定。 2. 表 16-2 放射免疫法测定 CEA 操作步骤 加入物(μl) NSB 管 B0 管 B1-B5 管 样品管 0ng/ml 标准品 100 100 - - 5~80ng/ml 标准品 - - 100 - 样品 - - - 100 抗 CEA - 100 100 100 蒸馏水 100 - - - 摇匀,37℃ 2h 125I-CEA 100 100 100 100 摇匀,4℃过夜,任选 3 管测放射性作为总 T 分离剂 1000 1000 1000 l000 2.室温下放置 15min,2 000r/min,离心 5min,弃上清,测定各管沉淀的放射性。 【计算】 1.计算各组反应管的复管平均计数率(cpm)。 2.计算各组反应管的 B/Bo(%)或 B/T(%): 100% ( ) ( ) ( ) ( ) / (%) − − = cpm NSB cpm cpm NSB cpm B BO 零标准管沉淀 沉淀物 100% ( ) ( ) ( ) ( ) / (%) − − = T cpm cpm cpm NSB cpm B T 管 本底 沉淀物 注:本底 cpm 为无反应系统的 cpm。 3.以 CEA 含量为横坐标(取半对数纸的对数边),各标准管测得的结合率(B/Bo%或 B/T%)为纵坐标, 绘制校正竞争抑制曲线,据此可求出样品中 CEA 的含量。 4.根据各样品管的 B/Bo(%)或 B/T(%)值;从剂量反应曲线中算出 CEA 的含量,单位是μg/L。 【参考范围】 血清 CEA<2.5μg/L (非吸烟者) 【临床意义】 1.恶性肿瘤的辅助诊断 CEA 检测虽然对恶性肿瘤不是一项特异的肿瘤标志,但结合临床和其他检 测项目,仍具有一定的临床意义。大量资料表明,恶性肿瘤患者中,血清 CEA 的测定有较高的阳性率

特别是胃肠道恶性肿瘤、肺癌、乳腺癌等患者血清 CEA 量可明显升高。2.有助于对病情和预后的判断肿瘤患者血清CEA含量增高程度和肿瘤转移与否具有一定的相关性一般没有转移病灶或临床症状不明显的恶性肿瘤患者,其血清CEA虽可升高,但多数(约70%)不超过5 ug/L。CEA的连续随访测定,对肿瘤病情判断意义更大。一般在病情好转时,血清CEA含量下降,病程发展时则可升高。若CEA水平持续不断升高,或其数值超过正常5~6倍者,提示预后不良。3.疗效判断手术切除肿瘤或化疗两者结合,治疗后病情有好转时,血清CEA含量可逐步下降,一般在术后7~30d可恢复至正常水平。如继续保持高浓度CEA,表明预后欠佳4.对肿瘤分期和病变程度的判断血浆CEA阳性率与乳腺癌的分期有关,I期14.8%阳性,IV期73%阳性;小细胞肺癌病人病情局限者血清CEA阳性率为47%,而病变广泛者阳性率达80%;鳞癌病变局限者阳性率为50%,有胸外转移者阳性率达90%。5.良性肿瘤的鉴别诊断在临床诊断常有困难的情况下,对血清CEA的浓度局限动态观察,有助于鉴别诊断。如CEA浓度逐渐升高则恶性肿瘤的可能性较大,反之多为良性肿瘤。【注意事项】1.反应体系的影响CEA的直接测定对离子、pH、胶态金属、细菌产物或有机分子等异常敏感,蒸馏水在用前必须滤过,防止可能生长的细菌污染。2.反应特性影响必须有足够量的合格标准品以保证长期质控。由于CEA反应性分子的不均一性,一种方法得到的CEA值在另一种方法中得不出,并且不同标准之间或不同方法间不能应用“校正因数”。最主要的是不能从购买试剂的公司获得CEA参照材料,因为参照材料的范围应由用于评价试剂的同一测定方法来确定3.标本的影响腹水中的肝素可非特异性地抑制 CEA-RIA,甚至透析后仍有抑制作用。【评价】1.CEA直接RIA测定法是最简便、经济、省时的一种方法,但又是最不敏感的方法。由于体液中CEA含量较低,对方法的灵敏度要求较高,故此法较少采用。临床实验室较多采用的是间接RIA测定法,对分离免疫复合物操作复杂,采用昂贵设备的透析、超过滤等方法,因条件所限,采用者少。大多数的实验室主要采用具有操作简单、经济、可连续检测较多样品的,具较高灵敏度、准确度及精密度的酶沉淀法。2.准确度回收试验96.5%~103%。精密度:当值为27.3μg/L时,批内CV<3%,批间CV<10%实验119放射免疫分析法测定CA19-9糖类抗原系列对检测胰腺癌,具有良好的灵敏度与特异性。其中糖链抗原19-9(carbohydrate antigen19-9,简称CA19-9)灵敏度为90%,特异性为91%,在所有肿瘤标志物中是比较突出的。CA19-9 的水平与胰腺肿瘤的大小有关,但与肿瘤在胰腺中的部位(头、体、尾)关系不大。CA19-9水平的高低可以作为肿瘤能否切除的预测,也可作为治疗后随访的指标,对复发进行监测。术后CA19-9恢复至正常病人中存活期超过18个月;而没有恢复至正常的,第8页共18页
第 8 页 共 18 页 特别是胃肠道恶性肿瘤、肺癌、乳腺癌等患者血清 CEA 量可明显升高。 2.有助于对病情和预后的判断 肿瘤患者血清 CEA 含量增高程度和肿瘤转移与否具有一定的相关性。 一般没有转移病灶或临床症状不明显的恶性肿瘤患者,其血清 CEA 虽可升高,但多数(约 70%)不超过 5μ g/L。CEA 的连续随访测定,对肿瘤病情判断意义更大。一般在病情好转时,血清 CEA 含量下降,病程发 展时则可升高。若 CEA 水平持续不断升高,或其数值超过正常 5~6 倍者,提示预后不良。 3.疗效判断 手术切除肿瘤或化疗两者结合,治疗后病情有好转时,血清 CEA 含量可逐步下降,一 般在术后 7~30d 可恢复至正常水平。如继续保持高浓度 CEA,表明预后欠佳。 4.对肿瘤分期和病变程度的判断 血浆 CEA 阳性率与乳腺癌的分期有关,Ⅰ期 14.8%阳性,Ⅳ期 73% 阳性;小细胞肺癌病人病情局限者血清 CEA 阳性率为 47%,而病变广泛者阳性率达 80%;鳞癌病变局限 者阳性率为 50%,有胸外转移者阳性率达 90%。 5.良性肿瘤的鉴别诊断 在临床诊断常有困难的情况下,对血清 CEA 的浓度局限动态观察,有助于 鉴别诊断。如 CEA 浓度逐渐升高则恶性肿瘤的可能性较大,反之多为良性肿瘤。 【注意事项】 1.反应体系的影响 CEA 的直接测定对离子、pH、胶态金属、细菌产物或有机分子等异常敏感,蒸 馏水在用前必须滤过,防止可能生长的细菌污染。 2.反应特性影响 必须有足够量的合格标准品以保证长期质控。由于 CEA 反应性分子的不均一性, 一种方法得到的 CEA 值在另一种方法中得不出,并且不同标准之间或不同方法间不能应用“校正因数”。 最主要的是不能从购买试剂的公司获得 CEA 参照材料,因为参照材料的范围应由用于评价试剂的同一测 定方法来确定。 3.标本的影响 腹水中的肝素可非特异性地抑制 CEA-RIA,甚至透析后仍有抑制作用。 【评价】 1.CEA 直接 RIA 测定法是最简便、经济、省时的一种方法,但又是最不敏感的方法。由于体液中 CEA 含量较低,对方法的灵敏度要求较高,故此法较少采用。临床实验室较多采用的是间接 RIA 测定法, 对分离免疫复合物操作复杂,采用昂贵设备的透析、超过滤等方法,因条件所限,采用者少。大多数的实 验室主要采用具有操作简单、经济、可连续检测较多样品的,具较高灵敏度、准确度及精密度的酶沉淀法。 2.准确度 回收试验 96.5%~103%。精密度:当值为 27.3μg/L 时,批内 CV<3%,批间 CV<10%。 实验 119 放射免疫分析法测定 CA19-9 糖 类 抗 原 系 列 对 检 测 胰 腺 癌 , 具 有 良 好 的 灵 敏 度 与 特 异 性 。 其 中 糖 链 抗 原 19-9(carbohydrate antigen19-9,简称 CA19-9)灵敏度为 90%,特异性为 91%,在所有肿瘤标志 物中是比较突出的。CA19-9 的水平与胰腺肿瘤的大小有关,但与肿瘤在胰腺中的部位(头、体、 尾)关系不大。CA19-9 水平的高低可以作为肿瘤能否切除的预测,也可作为治疗后随访的指标, 对复发进行监测。术后 CA19-9 恢复至正常病人中存活期超过 18 个月;而没有恢复至正常的

没有一例存活期超过12个月。偶有个别病例,胰腺肿瘤很大,甚至已有淋巴结转移,但CA19-9浓度正常。这类病人可能属于Lewis血型抗原阴性,不能表达CA19-9抗原。CA19-9是由1116NS19-9单抗所确立的抗原,此单抗来源于结肠癌细胞株。CA19-9的抗原决定簇是唾液酸化岩藻糖基乳四糖(sialosyl-fucosyl-lactotetraose),也就是睡液酸化的Lewisa血型抗原,【原理】胰腺癌患者血清中CA19-9的测定方法是利用双位点夹心法,采用特异性单克隆抗体(抗CA19-9IgG)包被聚苯乙烯管,制成固相抗体。将待测样品及标准液和此过量抗体混合温育,生成固相抗体-抗原复合物。后加入标记的1251抗CA19-9抗体进行温育,最后生成固相抗体-CA19-9标记抗体复合物(B),经洗涤可将剩余标记抗体(F)除去,保证了B、F的完全分离。上述反应原理显示,样品中CA19-9浓度越高,所形成的固相抗体-CA19-9-1251标记抗体复合物量越多,即B的放射性计数和CA19-9浓度呈正比。【试剂】1.固相抗体(一抗)用鼠抗CA19-9单克隆抗体包被聚乙烯管(或珠)。2~8℃保存,注意防潮。在试剂有效期内使用。2.标记抗体(二抗)液体状态的1251鼠抗CA19-9单克隆抗体。使用前轻轻混匀。开启后2~8℃冷藏,30d内稳定。3.标准液配制成每毫升非人血清基质中CA199含量依次为15、50、150、500、1500U。一20℃可保存2月。2~8℃冷藏,30d内稳定。4.质控物:冻干品,以非人血清为基质,含有不同浓度的CA19-9,加有防腐剂。使用前至少在室温中放置30min。复溶时每瓶准确地加入蒸馏水或去离子水1.0ml轻轻旋转使其溶解。复溶后2~8℃冷藏可稳定30d。冻干品在一20℃保存,可稳定6个月。5.浓缩洗涤缓冲液60ml浓缩型缓冲液,内含表面活性剂和防腐剂叠氮钠。每瓶用蒸馏水600ml稀释至总量为660ml。配制后在2~8℃冷藏可稳定6个月。6.稀释缓冲液(0.01mol/LPBS,pH7.4)加有防腐剂。冷藏保存,开启后在2~8℃保存可稳定30d。上述标记抗体、标准液及质控液在使用中均应避免反复冻融,以防活性降低。7.待检血清。【操作步骤】1.标本收集静脉穿刺采血后注入肝素或EDTA抗凝管内,注明采血时间,及时分离血浆或血清。溶血标本应注明,建议脂血标本用超速离心技术除去血中脂类。血浆标本在2~8℃冷藏可稳定1d,或一20℃冰冻冷藏可保存2月。分析前应将标本恢复至室温(15~18℃),并轻轻摇匀。当标本中的CA19-9浓度超过标准管最高限(1500U/ml)时,应当将标本用零标准液第9页共18页
第 9 页 共 18 页 没有一例存活期超过 12 个月。偶有个别病例,胰腺肿瘤很大,甚至已有淋巴结转移,但 CA19-9 浓度正常。这类病人可能属于 Lewis 血型抗原阴性,不能表达 CA19-9 抗原。CA19-9 是由 1116NS19-9 单抗所确立的抗原,此单抗来源于结肠癌细胞株。CA19-9 的抗原决定簇是唾液酸 化岩藻糖基乳四糖(sialosyl-fucosyl-lactotetraose),也就是唾液酸化的 Lewisa 血型抗原。 【原理】 胰腺癌患者血清中 CA19-9 的测定方法是利用双位点夹心法,采用特异性单克 隆抗体(抗 CA19-9 IgG)包被聚苯乙烯管,制成固相抗体。将待测样品及标准液和此过量抗体混 合温育,生成固相抗体-抗原复合物。后加入标记的 125I 抗 CA19-9 抗体进行温育,最后生成固 相抗体-CA19-9 标记抗体复合物(B),经洗涤可将剩余标记抗体(F)除去,保证了 B、F 的完全分 离。上述反应原理显示,样品中 CA19-9 浓度越高,所形成的固相抗体-CA19-9- 125I 标记抗体复 合物量越多,即 B 的放射性计数和 CA19-9浓度呈正比。 【试剂】 1.固相抗体(一抗) 用鼠抗 CA19-9 单克隆抗体包被聚乙烯管(或珠)。2~8℃保存,注意 防潮。在试剂有效期内使用。 2.标记抗体(二抗) 液体状态的 125I 鼠抗 CA19-9 单克隆抗体。使用前轻轻混匀。开启后 2~8℃冷藏,30d 内稳定。 3.标准液 配制成每毫升非人血清基质中 CA19-9 含量依次为 15、50、150、500、1 500U。 -20℃可保存 2 月。2~8℃冷藏,30d 内稳定。 4.质控物: 冻干品,以非人血清为基质,含有不同浓度的 CA19-9,加有防腐剂。使用 前至少在室温中放置 30min。复溶时每瓶准确地加入蒸馏水或去离子水 1.0ml 轻轻旋转使其溶 解。复溶后 2~8℃冷藏可稳定 30d。冻干品在-20℃保存,可稳定 6 个月。 5.浓缩洗涤缓冲液 60ml 浓缩型缓冲液,内含表面活性剂和防腐剂叠氮钠。每瓶用蒸 馏水 600ml 稀释至总量为 660ml。配制后在 2~8℃冷藏可稳定 6 个月。 6.稀释缓冲液(0.01mol/L PBS, pH7.4) 加有防腐剂。冷藏保存,开启后在 2~8℃保 存可稳定 30d。 上述标记抗体、标准液及质控液在使用中均应避免反复冻融,以防活性降低。 7.待检血清。 【操作步骤】 1.标本收集 静脉穿刺采血后注入肝素或 EDTA 抗凝管内,注明采血时间,及时分离血 浆或血清。溶血标本应注明,建议脂血标本用超速离心技术除去血中脂类。血浆标本在 2~8℃ 冷藏可稳定 1d,或-20℃冰冻冷藏可保存 2 月。分析前应将标本恢复至室温(15~18℃),并 轻轻摇匀。当标本中的 CA19-9 浓度超过标准管最高限(1 500U/ml)时,应当将标本用零标准液

稀释后重新测定,在计算结果时乘以稀释倍数2.从A~F标记12支以抗CA19.9单克隆抗体包被的聚苯乙烯管(均为双管),“A”管为非特异性结合(NSB)管,“F”为最大结合(Bmax)管(见表16-2)。同时将质控管和样品管作平行复管标记。表16-2A~F管每毫升单位数标准管U/mlT*(总计数管)。A(NSB)15 BC 50 D150E500F(Bmax)15003.向上述各管底部对应加入标准液50μ1,另将质控液及待测样品各50u1分别加入质控管及待测样品管中4.直接于每管底部加入稀释缓冲液各200u1,并使管内液体混合均匀。5.在振荡器上振摇60min。6.轻轻地彻底地将管内的液体倒出加入稀释过的洗涤缓冲液2ml,1~2min后再轻轻地倒出。除去残留的液体将可提高分析精密度。7.向各管底部加入1251抗CA199单克隆抗体200.u1将总计数管放在一边准备作总计数用。再在振荡器上摇60min。8.将管内液体倒净(动作要轻)加入洗涤缓冲液2ml,待1~2min后全部倒出。再重复洗涤一次后,彻底地倾出管内液体,并用吸水纸吸干管内残留水分(总计数管不作洗涤处理)在计数器中计数各管每分钟脉冲数(cpm)。【计算】1.算出各复管脉冲数的计数值的平均值。2.各标准管、质控管、样品管的计数值均应减去NSB管计数值:3.计算各管B/Bmax结合率(%),B(cpm) -NSB(cpm)B/Bma(%)-X100%B (cpm) -NSB(cpm)4.以各标准管浓度为横坐标(取半对数纸对数边),以B/Bmax为纵坐标;绘制出反"S"型第10页共18页
第 10 页 共 18 页 稀释后重新测定,在计算结果时乘以稀释倍数。 2.从 A~F 标记 12 支以抗 CA19-9 单克隆抗体包被的聚苯乙烯管(均为双管),“A”管为 非特异性结合(NSB)管,“F”为最大结合(Bmax)管(见表 16-2)。同时将质控管和样品管作平行 复管标记。 表 16-2 A~F 管每毫升单位数 标准管 U/ml T*(总计数管) - A(NSB) 0 B 15 C 50 D 150 E 500 F(Bmax) 1500 3.向上述各管底部对应加入标准液 50μ1,另将质控液及待测样品各 50μ1 分别加入质 控管及待测样品管中。 4.直接于每管底部加入稀释缓冲液各 200μl,并使管内液体混合均匀。 5.在振荡器上振摇 60min。 6.轻轻地彻底地将管内的液体倒出 加入稀释过的洗涤缓冲液 2ml,1~2min 后再轻轻 地倒出。除去残留的液体将可提高分析精密度。 7.向各管底部加入 125I 抗 CA19-9 单克隆抗体 200μl 将总计数管放在一边准备作总计数 用。再在振荡器上摇 60min。 8.将管内液体倒净(动作要轻) 加入洗涤缓冲液 2ml,待 1~2min 后全部倒出。再重复 洗涤一次后,彻底地倾出管内液体,并用吸水纸吸干管内残留水分(总计数管不作洗涤处理)。 在γ计数器中计数各管每分钟脉冲数(cpm)。 【计算】 1.算出各复管脉冲数的计数值的平均值。 2.各标准管、质控管、样品管的计数值均应减去 NSB 管计数值: 3.计算各管 B/Bmax 结合率(%), B/Bmax(%)= B (cpm) NSB(cpm) B(cpm) NSB(cpm) max − − × 100% 4.以各标准管浓度为横坐标(取半对数纸对数边),以 B/Bmax 为纵坐标;绘制出反“S”型
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《临床生物化学》课程教学资源(实验指导)第15章 常用治疗性药物监测.doc
- 《临床生物化学》课程教学资源(实验指导)第14章 常用酶类测定.doc
- 《临床生物化学》课程教学资源(实验指导)第13章 非蛋白含氮化合物及总胆汁酸测定.doc
- 《临床生物化学》课程教学资源(实验指导)第11章 血气分析.doc
- 《临床生物化学》课程教学资源(实验指导)第10章 无机离子及微量元素测定.doc
- 《临床生物化学》课程教学资源(实验指导)第9章 血清(浆)脂类及脂蛋白测定.doc
- 《临床生物化学》课程教学资源(实验指导)第7章 血清(浆)蛋白质测定.doc
- 《临床生物化学》课程教学资源(实验指导)第6章 方法学评价与试剂盒评价实验.doc
- 《临床生物化学》课程教学资源(实验指导)第5章 分子生物学实验技术.doc
- 《临床生物化学》课程教学资源(实验指导)第4章 酶学基本知识实验.doc
- 《临床生物化学》课程教学资源(实验指导)第3章 电泳技术.doc
- 《临床生物化学》课程教学资源(实验指导)第2章 层析技术.doc
- 《临床生物化学》课程教学资源(实验指导)第1章 光谱技术.doc
- 《临床生物化学》课程教学资源(作业习题)第十九章 自动临床生物化学分析仪的应用及评价(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十九章 自动临床生物化学分析仪的应用及评价(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十八章 治疗药物浓度监测(TDM)(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十八章 治疗药物浓度监测(TDM)(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十七章 妊娠的生物化学检验(答案).pdf
- 《临床生物化学》课程教学资源(作业习题)第十七章 妊娠的生物化学检验(题目).pdf
- 《临床生物化学》课程教学资源(作业习题)第十六章 肿瘤的生物化学检验(答案).pdf
- 《临床生物化学》课程教学资源(实验指导)第17章 神经递质与其他活性物质的测定.doc
- 《临床生物化学》课程教学资源(实验指导)第18章 临床化学实验室基础.doc
- 《临床生物化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 《临床生物化学》课程教学资源(PPT课件)第二章 生物化学检验中的诊断酶学.ppt
- 《临床生物化学》课程教学资源(PPT课件)第三章 血浆蛋白质与含氮化合物的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第四章 糖代谢紊乱的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第五章 血浆脂蛋白代谢紊乱的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第六章 电解质和酸碱平衡紊乱的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第七章 骨代谢紊乱及相关元素的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第八章 微量元素与维生素异常的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第九章 营养状况的评估及的生物化学监测.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十章 肝胆疾病的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十一章 肾功能损伤的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十二章 心血管系统疾病的生物化学检测.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十三章 内分泌疾病的生物化学检测.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十四章 消化系统疾病的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十五章 神经系统疾病的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十六章 肿瘤标志物的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十七章 妊娠的生物化学检验.ppt
- 《临床生物化学》课程教学资源(PPT课件)第十八章 治疗药物浓度监测.ppt
