吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(10/13)

2)电解池: 电解池:充电过程,电能一→化学能 例:Zn++Cu 一→ Zn+Cu+不能发生 若在可逆电池:电解,能发生 (-)Zn++2e一→Zm 还原,阴极 (+)Cu-→Cu++2e 氧化,阳极 总反应:Zn++Cu一→Zn+Cu+
1 2)电解池: 电解池:充电过程,电能—→化学能 例:Zn++ + Cu —→ Zn + Cu++ 不能发生 若在可逆电池:电解,能发生 (-)Zn++ + 2e —→ Zn 还原,阴极 (+)Cu —→ Cu++ + 2e 氧化,阳极 总反应:Zn++ + Cu —→ Zn + Cu++
Zn ZnSO4 CuSOa 2
2

说明:a)电解池: 负极(-):还原反应 阳极(+):氧化反应 3.电池的表示 1)“|”或“,”表示不同相的接界, “‖”表示盐桥 例:Zn(s)|H2SO4(I)|Cu(s) Zn (s)ZnCl (1)AgCI (s),Ag (s) Zn (s)ZnSO (1)II CuSO (1)Cu (s) 3
3 负极(-):还原反应 阳极(+):氧化反应 说明:a)电解池: 3. 电池的表示 1)“∣”或“,”表示不同相的接界, “‖”表示盐桥 例: Zn(s)∣H2 SO4(l)∣Cu(s) Zn(s)∣ZnCl2(l)∣AgCl(s), Ag(s) Zn(s)∣ZnSO4(l)‖CuSO4(l)∣Cu(s)

2)写原电池时,一般左边(一)极, 右边(十)极 3)标出体系T,P,m及物态, 298K,P,m=m°,可略 4)气体电极,因气体不能直接作为电极, 必须惰性金属如Pt,惰性电极不参加 反应,可略 (Pt),H2(g,P)HSO(m)O2(g,P2),(Pt)
4 2)写原电池时,一般左边(-)极, 右边(+)极 3)标出体系 T,P,m 及物态, 298K,P θ,m=mθ,可略 4)气体电极,因气体不能直接作为电极, 必须惰性金属如 Pt,惰性电极不参加 反应,可略 (Pt), H2 (g,P1 ) ∣HSO4 (m) ∣O2 (g,P2 ), (Pt)

二.电化学反应的△G1,p和可逆电池电动势 1.电化学反应△Gm,P 等T,P,可逆条件下:-△GT,=W可' W可'=nFE n; 电极反应中得失电子数 E:电池的电动势 -A GT,P=nFE 表示可逆电池的化学势来源于化学能 在T,P,可逆:-△,G,=nFE E:标准电池的电动势 5
5 二.电化学反应的Δ rGT,P和可逆电池电动势 1. 电化学反应Δ rGT,P 等 T,P,可逆条件下:-Δ rGT,P =W 可 ' W 可 '=nFE n:电极反应中得失电子数 E:电池的电动势 -Δ rGT,P = nFE 表示可逆电池的化学势来源于化学能 在 T,P θ,可逆:-Δ rG θ T,P = nFEθ E θ:标准电池的电动势

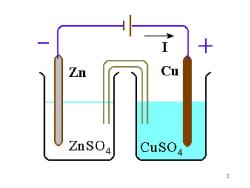
2.可逆电池的电动势E 1)电动势(电位差)E: 例:Zu,Cu电池 由Zu,Cu棒构成两电极,放在电解液中, 用盐桥连接两电解液,将两电极连接,产 生电动势,这是电子流动产生电流引起的 电动势E:与T,P,电解液浓度m等有关 2)可逆电池电动势 E,E°:电化学的重要参数 6
6 例:Zu,Cu 电池 由 Zu,Cu 棒构成两电极,放在电解液中, 用盐桥连接两电解液,将两电极连接,产 生电动势,这是电子流动产生电流引起的 2. 可逆电池的电动势 E 1)电动势(电位差)E: 电动势 E:与 T,P,电解液浓度 m 等有关 2)可逆电池电动势 E,E θ:电化学的重要参数

-△,G,=nFE,-△G°,=nFE 由热力学量求出电化学量,显然此式为热 力学和电化学的桥梁 例:Zn+Cu+ Zn++Cu 298K,P:△G°,p=-212.19K/mol E=-A.GT.r/nF-1.10J/C-1.10V 三、可逆电池和不可逆电池 电池反应:若以可逆过程实现为可逆电 池,用热力学讨论 7
7 -Δ rGT,P = nFE,-Δ rG θ T,P = nFEθ 由热力学量求出电化学量,显然此式为热 力学和电化学的桥梁 例:Zn+ Cu++ —→ Zn++ + Cu 298K,P θ :Δ rG θ T,P = - 212.19KJ/mol E θ= -Δ rG θ T,P /nF=1.10J/C=1.10V 三、可逆电池和不可逆电池 电池反应:若以可逆过程实现为可逆电 池,用热力学讨论

若以不可逆过程实现,为不可逆电池,用 动力学速率理论,过渡态理论讨论 1.可逆电池必须满足两个条件: 1)电池中发生的化学反应必须是可逆 正反两方向进行,即充放电反应互为可逆 放电电池:原电池,外加电动势电池电动势 电池充放电后,化学反应体系复原 8
8 若以不可逆过程实现,为不可逆电池,用 动力学速率理论,过渡态理论讨论 1. 可逆电池必须满足两个条件: 1)电池中发生的化学反应必须是可逆 正反两方向进行,即充放电反应互为可逆 放电电池:原电池,外加电动势电池电动势 电池充放电后,化学反应体系复原
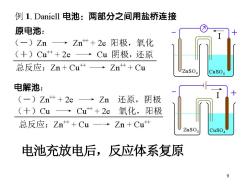
例1.Daniell电池:两部分之间用盐桥连接 原电池: (一)Zn→Zn++2e阳极,氧化 (十)Cu++2eCu阴极,还原 总反应:Zn+Cu+→Zn++Cu ZnSO 电解池: (-)Zn++2e→Zn 还原,阴极 (+)Cu →Cu++2e 氧化, 阳极 总反应:Zn++Cu一→Zn+Cu+ 电池充放电后,反应体系复原 9
9 电池充放电后,反应体系复原
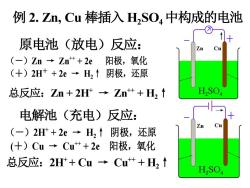
例2.Zn,Cu棒插入HSO4中构成的电池 原电池(放电)反应: (-)Zn→Zn++2e阳极,氧化 (+)2H++2e→H,↑阴极,还原 总反应:Zn+2H→Zn++H, 电解池(充电)反应: (-)2H+2e→H,↑阴极,还原 (+)Cu→Cu++2e阳极,氧化 总反应:2H+Cu→Cu艹+H,↑ H,SO
10 例 2. Zn, Cu 棒插入 H2 SO4中构成的电池 原电池(放电)反应: (-)Zn → Zn++ + 2e 阳极,氧化 (+)2H+ + 2e → H2↑ 阴极,还原 总反应:Zn + 2H+ → Zn++ + H2↑ 电解池(充电)反应: (-)2H+ + 2e → H2↑ 阴极,还原 (+)Cu → Cu++ + 2e 阳极,氧化 总反应:2H+ + Cu → Cu++ + H2↑
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(3/4)二组分液固体系.ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律(3/6).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(04/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(17/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(14/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第一章 统计热力学(图片版,3/5).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(09/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(06/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(9/9).ppt
- 山西医科大学:《生物化学》课程教学课件(讲稿)第13章 核苷酸代谢 The Nucleotide Metabolism.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第12章 氨基酸代谢 Metabolism of Amino Acids.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第二篇 物质代谢与能量代谢 第9章 三羧酸循环 Tricarboxylic Acid Cycle.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第7章 糖代谢 Carbohydrate Metabolism.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第5章 酶与其他生物催化剂 Enzymes and Other Biocatalysts.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第3章 脂类与复合脂 Lipids and Lipid Complex.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第2章 糖与糖复合物 Carbohydrate and Glycoconjugate.pdf
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第十章 氢离子代谢(酸碱代谢).ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第七章 含氮化合物代谢.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第四章 三酸酸循环和氧化磷酸化.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第二章 核酸的结构与功能.ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(13/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(8/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡(3/3).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.1-2.5)熵(entropy)、卡诺定理、熵增原理、熵的计算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(2/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §1 分散系统(dispersed system).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.4-4.5)固-液二元体系相图(solid-liqiud phase diagram)、二级相变 second order phase transition.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十二章 物质代谢的调节控制.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第六章 糖类代谢.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第一章 溶液.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第2章 化学热力学基础.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十四章 β-二羰基化合物.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十五章 硝基化合物及胺.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十七章 杂环化合物.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十九章 氨基酸、蛋白质、核酸.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第八章 立体化学.pptx
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第九章 卤代烃(haloalkanes).ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第10章 界面现象.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第4章 多组分系统热力学.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第十三章 杂环化合物.ppt
