华南理工大学:《物理化学》课程电子教案(PPT教学课件)第4章 多组分系统热力学
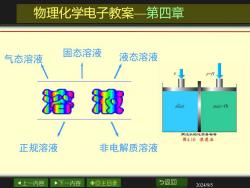
物理化学电子教案一第四章 固态溶液 气态溶液 液态溶液 0+7 溜双 HA(p+I) 两边水的化学势相等 图4.10渗透压 正规溶液 非电解质溶液 上一内容 下一内容 ◇回主目录 b返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 物理化学电子教案—第四章 气态溶液 固态溶液 液态溶液 正规溶液 非电解质溶液

第四章 多组分系统热力学 §4.1偏摩尔量 84.2 溶液组成的表示法 §4.3偏摩尔量与化学势 §4.4稀溶液中的两个经验定律 §4.5混合气体中各组分的化学势 §4.6液体混合物 §4.7 稀溶液中各组分的化学势 §4.8 稀溶液的依数性 84.9 Duhem-Margules公式 §4.10非理想溶液 §4.11分配定律 4上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 第四章 多组分系统热力学 §4.1 偏摩尔量 §4.2 溶液组成的表示法 §4.3 偏摩尔量与化学势 §4.4 稀溶液中的两个经验定律 §4.5 混合气体中各组分的化学势 §4.6 液体混合物 §4.7 稀溶液中各组分的化学势 §4.8 稀溶液的依数性 §4.9 Duhem-Margules公式 §4.10 非理想溶液 §4.11 分配定律

第四章 多组分系统热力学 溶液(solution) 广义地说,两种或两种以上物质彼此以分子或 离子状态均匀混合所形成的体系称为溶液。 溶液以物态可分为气态溶液、固态溶液和液态 溶液。根据溶液中溶质的导电性又可分为电解质溶 液和非电解质溶液。 本章主要讨论液态的非电解质溶液。 4上一内容 下一内容 ◇回主目录 5返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 第四章 多组分系统热力学 溶液(solution) 广义地说,两种或两种以上物质彼此以分子或 离子状态均匀混合所形成的体系称为溶液。 溶液以物态可分为气态溶液、固态溶液和液态 溶液。根据溶液中溶质的导电性又可分为电解质溶 液和非电解质溶液。 本章主要讨论液态的非电解质溶液
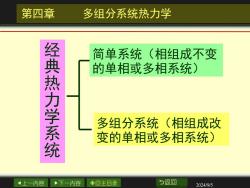
第四章 多组分系统热力学 简单系统(相组成不变 经典热力学系统 的单相或多相系统) 多组分系统(相组成改 变的单相或多相系统)》 上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 第四章 多组分系统热力学 经 典 热 力 学 系 统 简单系统(相组成不变 的单相或多相系统) 多组分系统(相组成改 变的单相或多相系统)

第四章 多组分系统热力学 溶剂(solvent) 和溶质(solute) 如果组成溶液的物质有不同的状态,通常将液 态物质称为溶剂,气态或固态物质称为溶质。 如果都是液态,则把含量多的一种称为溶剂, 含量少的称为溶质。 上一内容 下一内容 ◇回主目录 5返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 第四章 多组分系统热力学 溶剂(solvent)和溶质(solute) 如果组成溶液的物质有不同的状态,通常将液 态物质称为溶剂,气态或固态物质称为溶质。 如果都是液态,则把含量多的一种称为溶剂, 含量少的称为溶质

第四章 多组分系统热力学 混合物(mixture) 多组分均匀体系中,溶剂和溶质不加区分,各 组分均可选用相同的标准态,使用相同的经验定律, 这种体系称为混合物,也可分为气态混合物、液态 混合物和固态混合物。 上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 第四章 多组分系统热力学 混合物(mixture) 多组分均匀体系中,溶剂和溶质不加区分,各 组分均可选用相同的标准态,使用相同的经验定律, 这种体系称为混合物,也可分为气态混合物、液态 混合物和固态混合物

§4.1偏摩尔量 。问题的提出 ·偏摩尔量 ·偏摩尔量的测定法举例 ·偏摩尔量与摩尔量的差别 ·右布斯-杜亥姆方程 ·偏摩尔量之间的函数关系 上一内容 下一内容 ◇回主目录 5返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 §4.1 偏摩尔量 • 问题的提出 • 偏摩尔量 • 偏摩尔量的测定法举例 • 偏摩尔量与摩尔量的差别 • 右布斯-杜亥姆方程 • 偏摩尔量之间的函数关系

1.问题的提出 18.09cm3 三 36.18cm3 18.09cm3 1molH20(①)+1molH20( Vm*水=18.09cm3mo V=n'm水=36.18cm3 4上一内容 下一内容 ◇回主目录 与返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 1.问题的提出 18.09 cm3 = 36.18 cm3 1mol H2O (l) + 1mol H2O (l) Vm * 水= 18.09 cm3·mol–1 V* = nVm * 水= 36.18 cm3 18.09 cm3

1.问题的提出 58.35cm3 二 116.70cm3 58.35cm3 1mol C2HsOH (1)+1mol C,HOH (1) Vm乙醇=58.35cm3moH 产-n'm*乙醇=116.70cm3 上一内容 下一内容 ◇回主目录 b返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 1.问题的提出 1mol C2H5OH(l)+ 1mol C2H5OH(l) Vm * 乙醇 = 58.35 cm3·mol-1 V* = nVm * 乙醇 = 116.70 cm3 58.35 cm3 58.35 cm3 = 116.70 cm3

1.问题的提出 18.09cm3 74.40cm3 58.35cm3 水'm水+nz醇'm乙醇=76.44cm3 V=n水V水+nz醇V乙醇 4上一内容 下一内容 ◇回主目录 b返回 2024/9/5
上一内容 下一内容 回主目录 返回 2024/9/5 1.问题的提出 58.35 cm3 18.09 cm3 = 74.40 cm3 V≠n水Vm * 水 + n乙醇Vm * 乙醇 = 76.44 cm3 V = n水V水 + n乙醇V乙醇
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第10章 界面现象.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第九章 卤代烃(haloalkanes).ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第八章 立体化学.pptx
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十九章 氨基酸、蛋白质、核酸.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十七章 杂环化合物.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十五章 硝基化合物及胺.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十四章 β-二羰基化合物.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第2章 化学热力学基础.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第一章 溶液.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第六章 糖类代谢.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十二章 物质代谢的调节控制.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.4-4.5)固-液二元体系相图(solid-liqiud phase diagram)、二级相变 second order phase transition.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §1 分散系统(dispersed system).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(2/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.1-2.5)熵(entropy)、卡诺定理、熵增原理、熵的计算.ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡(3/3).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(8/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(13/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(10/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(3/4)二组分液固体系.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第十三章 杂环化合物.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第二章 烷烃.pptx
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第七章 卤代烃.pptx
- 济源职业技术学院:《无机及分析化学》课程教学资源(PPT课件)第三章 原子结构和元素周期表.pptx
- 济源职业技术学院:《无机及分析化学》课程教学资源(PPT课件)第六章 酸碱平衡和酸碱滴定法.pptx
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第十一章 电化学基础.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十一章 P区元素.ppt
- 河南师范大学:《无机化学》课程教学课件(PPT讲稿)第二十四章 周环反应 Pericyclic reaction.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第二章 烷烃 Alkanes.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第五章 卤代烃 haloalkanes.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十七章 胺.ppt
- 河南师范大学:《物理化学》课程教学资源(PPT课件)第十二章 胶体及大分子溶液.ppt
- 河南师范大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律.ppt
- 河南师范大学:《物理化学》课程教学资源(PPT课件)第六章 统计热力学初步.ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第十章 生物膜的结构与功能 Function and structure of bioomembranes.ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第一章 核酸化学.ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第五章 脂类代谢.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(基础生物化学)第五章 脂类代谢.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(本科双语教学)第二章 蛋白质 Amino Acids.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(本科双语教学)第六章 含氮化合物代谢 Nucleotides and Nucleic Acids.ppt
