吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(13/13)

§8-6 电解和极化现象 可逆电池:用热力学方法处理 不可逆的电极过程:对电镀、电化腐蚀等有意义 一、极化和超电势 可逆电池:原电池,放电过程 电解池:电池充电过程 正负离子分别向阴阳极迁移,发生氧化还 原反应一一电解过程 E外>E电池 1.极化 原电池:)P),H,(P)|HSO4(a)|O2P),(P)+) 可逆:E=Φ+Φ
1 §8-6 电解和极化现象 可逆电池:用热力学方法处理 不可逆的电极过程:对电镀、电化腐蚀等有意义 一、极化和超电势 可逆电池:原电池,放电过程 电解池:电池充电过程 正负离子分别向阴阳极迁移,发生氧化还 原反应——电解过程 E 外 > E 电池 1. 极化 原电池: (-)(Pt), H2 (P1 )│H2 SO4 (a)│O2 (P2 ), (Pt)(+) 可逆:E = φ+ - φ-

电池反应HL2+1/202一→H20L) 电解池:()2H+2e一→H2 (+)H201/202+2Ht+2e H20-→H2+1/202 E电解>E可逆=中+一中 表示充电电动势要大于平衡电动势 这种偏离平衡电极电势的现象 极化现象 2
2 电解池:(-) 2H+ + 2e —→ H2 (+) H2 O —→ 1/2O2 + 2H+ + 2e H2 O —→H2 + 1/2O2 电池反应:H2 + 1/2O2 —→ H2O(L) E 电解 > E 可逆=ф+ -ф- 表示充电电动势要大于平衡电动势 这种偏离平衡电极电势的现象 ——极化现象

极化定义:在一定电流I通过电池时,电 池所表现出的电动势E与可逆电池的电动 势E可发生偏差的现象叫极化,这个偏差 的大小表示极化程度的高低 超电势(过电势)1:偏差的大小,n大 小表示极化程度 2.超电势n 1) 定义:在电解过程中,不可逆电极电 势Φ与平衡电极电势Φ平之差 3
3 极化定义:在一定电流 I 通过电池时,电 池所表现出的电动势 E 与可逆电池的电动 势 E 可发生偏差的现象叫极化,这个偏差 的大小表示极化程度的高低 超电势(过电势)η:偏差的大小,η大 小表示极化程度 2. 超电势η 1) 定义:在电解过程中,不可逆电极电 势φ与平衡电极电势φ平之差

a)规定n>0: 阳=中阳中平(阳) n阴=中平(阴)·中阴 b)不可逆过程:中阳=中平(阳)+n阳 Φ阴=中平(阴)1阴 c)电解电压(分解电压) E分=中阳中阴 说明:不可逆过程既电解过程,使阴极电 势更负,阳极电势更正
4 a) 规定η>0: η阳 =φ阳-φ平(阳) η阴 =φ平(阴)-φ阴 φ阳=φ平(阳)+η阳 φ阴=φ平(阴)-η阴 b) 不可逆过程: c) 电解电压(分解电压) E 分=φ阳-φ阴 说明:不可逆过程既电解过程,使阴极电 势更负,阳极电势更正
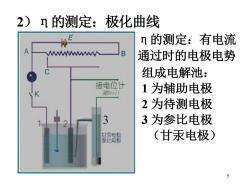
2)n的测定: 极化曲线 n的测定:有电流 MW B 通过时的电极电势 组成电解池: 接电位计 测Ecell 1为辅助电极 2为待测电极 3为参比电极 比电极 (甘汞电极) 5
5 2)η的测定:极化曲线组成电解池: 1 为辅助电极 2 为待测电极 3 为参比电极 (甘汞电极) η的测定:有电流 通过时的电极电势

极化曲线:电极电势Φ随电流密度i的 变化关系 毛细管+搅拌:可降低或消除电阻极化和 浓差极化 实际测得的结果为电化学极化的贡献 实验中,测定电极2的工作电流密度和电 位Φ作出极化曲线 Φ与Φ平之差即为n 显然,i不同,Φ不同,n也不同 结论: i↑,n↑,Φ阳↑,Φ阴↓
6 极化曲线:电极电势φ随电流密度 i 的 变化关系 毛细管+搅拌:可降低或消除电阻极化和 浓差极化 实际测得的结果为电化学极化的贡献 实验中,测定电极 2 的工作电流密度和电 位φ作出极化曲线 φ与φ平之差即为η 显然,i 不同,φ不同,η也不同
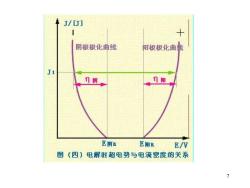
J/[J] 阴极极化曲线 阳极极化曲我 门街 门阳 E街B E阳E E/V 图(四】电解时超电势与电流密度的关系 7
7

二、电解时的电极反应 1.阴极反应:电解时发生还原反应 若溶液中有多种金属离子和,哪种阳 离子先在电极上析出,发生还原反应,取 决于每种离子在阴极上的还原电势,即阴 极电势之大小 Φ阴越高越先析出 外电压E=中阳中阴 若Φ阳不变,Φ阴越大,E越小 外加E很小,Φ阴大的先析出,Φ阴小的后析出
8 二、电解时的电极反应 1. 阴极反应:电解时发生还原反应 若溶液中有多种金属离子和 H + , 哪种阳 离子先在电极上析出,发生还原反应,取 决于每种离子在阴极上的还原电势,即阴 极电势之大小 φ阴越高越先析出 外电压 E =φ阳-φ阴 若φ阳不变,φ阴越大,E 越小 外加 E 很小,φ阴大的先析出,φ阴小的后析出

中阴=少(甲n阴=中导-1 nF a还原态一n阴 氧化态 中阴:取决于中°平,ag,n阴 例:电解ZnS04(a=1),用两种电极(Pt,Pb), 考察Zn+,H两种离子的析出顺序 查表:Φzmz=-0.763V,Φ°m=0,pH=7,am=10 1)Pt电极上:nz2+-0,nm-0 Zn2++2e—→Zn =-0.763V 9
9 φ阴:取决于φo 平,aB,η阴 例:电解 ZnSO4 (a=1), 用两种电极(Pt, Pb), 考察 Zn2+, H+两种离子的析出顺序 查表:φo Zn++/Zn= -0.763V, φo H+ / H2= 0, pH=7, aH+=10-7 1) Pt 电极上:ηZn2+=0,ηH2=0 Zn2+ + 2e —→ Zn

2H+2e 一→H2 2F aH+ Φrl,>ΦznZn H,先析出 2)在Pb电极上:查表nzm→0,nm=1.09V 求出Φmmm=-0.763V,ΦrH=-0.41-1=-1.50V Φzaz>Φrm,Zn先析出 当φ阴→1.50V时,H2才析出,此时Zn2]已很小 说明:a)阴极析出:金属离子和H 水溶液中,H还原为H, 10
10 2H+ + 2e —→ H2 φH+ /H2 >φZn++/Zn H2先析出 2)在 Pb 电极上: 查表ηZn →0 , ηH2 =1.09V 求出φZn2+/Zn= -0.763V,φH+ /H2 = -0.41-ηH2= -1.50V φZn++/Zn>φH+ /H2 Zn 先析出 当φ阴→-1.50V 时, H2才析出,此时[Zn2+]已很小 说明:a)阴极析出:金属离子和 H + 水溶液中,H +还原为 H2
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(10/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第五章 热力学在相平衡体系中的应用(3/4)二组分液固体系.ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律(3/6).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(04/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(17/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(14/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第一章 统计热力学(图片版,3/5).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(09/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(06/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(9/9).ppt
- 山西医科大学:《生物化学》课程教学课件(讲稿)第13章 核苷酸代谢 The Nucleotide Metabolism.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第12章 氨基酸代谢 Metabolism of Amino Acids.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第二篇 物质代谢与能量代谢 第9章 三羧酸循环 Tricarboxylic Acid Cycle.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第7章 糖代谢 Carbohydrate Metabolism.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第5章 酶与其他生物催化剂 Enzymes and Other Biocatalysts.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第3章 脂类与复合脂 Lipids and Lipid Complex.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第2章 糖与糖复合物 Carbohydrate and Glycoconjugate.pdf
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第十章 氢离子代谢(酸碱代谢).ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第七章 含氮化合物代谢.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第四章 三酸酸循环和氧化磷酸化.ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第八章 电化学(8/13).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡(3/3).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第二定律(2.1-2.5)熵(entropy)、卡诺定理、熵增原理、熵的计算.ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十三章 表面化学(2/7).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第十四章 胶体化学 §1 分散系统(dispersed system).ppt
- 武汉大学:《物理化学》课程教学资源(PPT课件)第四章 相平衡(4.4-4.5)固-液二元体系相图(solid-liqiud phase diagram)、二级相变 second order phase transition.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第十二章 物质代谢的调节控制.ppt
- 河南牧业经济学院(郑州牧业高等专科学校):《生物化学》课程教学资源(PPT课件)第六章 糖类代谢.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第一章 溶液.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第2章 化学热力学基础.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十四章 β-二羰基化合物.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十五章 硝基化合物及胺.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十七章 杂环化合物.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十九章 氨基酸、蛋白质、核酸.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第八章 立体化学.pptx
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第九章 卤代烃(haloalkanes).ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第10章 界面现象.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第4章 多组分系统热力学.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第十三章 杂环化合物.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第二章 烷烃.pptx
