福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十三章 氧族元素

第十三章氧族元素 §13.10、S通性 0°A020.68H2021.78H20 032.07H20+02 02-0.08HO20.87OH ① 中间价态H2O2可歧化分解(热,催化 剂MnO2) ② 既可作氧化剂,又可作还原剂
第十三章 氧族元素 §13.1 O、S通性 A O2 0.68 H2O2 1.78 H2O O3 2.07 H2O+O2 B O2 -0.08 HO2 - 0.87 OH- ① 中间价态H2O2可歧化分解(热,催化 剂MnO2) ② 既可作氧化剂,又可作还原剂
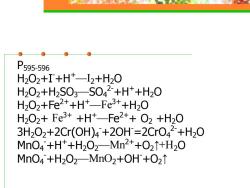
P595-596 H202+I+Ht-2+H20 H202+H2S03-S042+H+H20 H202+fe2++Ht-Fe3+H20 H202+Fe3++H+-Fe2++O2+H20 3H202+2Cr(OH)4+20H=2CrO42+H20 MnO4+H*+H2O2-Mn2++O21+H2O MnO4+H202MnO2+OH+O21
P595-596 H2O2+I-+H+—I2+H2O H2O2+H2SO3—SO4 2-+H++H2O H2O2+Fe2++H+—Fe3++H2O H2O2+ Fe3+ +H+—Fe2++ O2 +H2O 3H2O2+2Cr(OH)4 -+2OH-=2CrO4 2-+H2O MnO4 -+H++H2O2—Mn2++O2↑+H2O MnO4 -+H2O2—MnO2+OH-+O2↑

制备:H202 BaO2+H2SO4-H202+BaSO4 或:BaO2+C02+H20-H202+BaC03 电解:NH4HSO4(NH4)2S2O8+H21 ③臭氧 性质:O3+I+H202+O2+OH 环保:处理电镀液 O3+CN =OCN+O2 20CN+O3+H20=2C02+N2+2OH 自来水消毒、杀菌
③臭氧 性质:O3+I-+H2O—I2+O2+OH- 环保:处理电镀液 O3+CN-=OCN-+O2 2OCN-+O3+H2O=2CO2+N2+2OH- 自来水消毒、杀菌 制备: H2O2 BaO2+H2SO4—H2O2+BaSO4 或:BaO2+CO2+H2O—H2O2+BaCO3 电解:NH4HSO4—(NH4)2S2O8+H2↑

§13-2硫和它的化合物 自然界中含硫化合物较广 黄铁矿FeS2重晶石BaSO4方铅矿PbS天 青石SrS04闪锌矿ZnS石膏CaS04 芒硝Na2S0410H20镉黄CdS辉锑矿 Sb2S3锌钡白(立德粉)ZnS04+BaS HgS、As2S3、As4S4
§13-2 硫和它的化合物 自然界中含硫化合物较广 黄铁矿FeS2 重晶石 BaSO4 方铅矿PbS 天 青石SrSO4 闪锌矿ZnS 石膏CaSO4 芒硝Na2SO4·10H2O 镉黄CdS 辉锑矿 Sb2S3 锌钡白(立德粉)ZnSO4+BaS HgS 、As2S3、 As4S4

1.单质硫Sg 斜方硫(稳定) →单斜硫 mp:385.8K368.4K→392K S8→单斜→熔化→拉伸弹性硫破坏→S6,S3,S2 433K >563K
⒈单质硫S8 斜方硫(稳定) →单斜硫 mp:385.8K 368.4K → 392K S8→单斜→熔化→拉伸弹性硫破坏→S6,S3,S2 433K >563K

2.。 H2S:FeS(s)+H2SO4(aq)=H2S(g)+FeSO4 Na2S(aq)+H2SO4(aq)=H2S(g)+Na2SO4 0°sH2s-0.14v0°sys2.=-0.45V H2S+H2→S H2S+02→S H2S+Br2→H2SO4+HBr 3金属硫化物:多带色,是难溶物 Ag2S、H CuS CdS、PbS、SnS MnS、 FeS可溶: 王水HNO3 6MH+ 0.3MH+
⒉ H2S:FeS(s)+H2SO4(aq)=H2S(g)+FeSO4 Na2S(aq)+H2SO4(aq)=H2S(g)+Na2SO4 S/H2S=0.14v S/S2-=-0.45v H2S+I2→S H2S+O2→S H2S+Br2→H2SO4+HBr ⒊金属硫化物:多带色,是难溶物 Ag2S、HgS CuS CdS、PbS、SnS MnS、 FeS可溶: 王水 HNO3 6MH+ 0.3MH+

4.硫含氧酸(多为盐形式存在) 612 次硫酸 H2S02 亚硫酸 H2S03 焦亚硫酸盐Na2S2O5 一缩二亚 H2S204 硫酸 H2SO4V 焦硫酸 H2S207 V H2S203 连多硫酸 H2SxO6 过二硫酸 H2S208 V
⒋硫含氧酸(多为盐形式存在) P612 次硫酸 H2SO2 亚硫酸 H2SO3 √ 焦亚硫酸盐 Na2S2O5 一缩二亚 H2S2O4 硫酸 H2SO4 √ 焦硫酸 H2S2O7 H2S2O3 √ 连多硫酸 H2SXO6 过二硫酸 H2S2O8 √

还原性(为主) H20+S032-+Cl2→S042-+C+H+ 氧化:H++S032+H2S→S↓+H20 Na2S204强还原剂 2S032+2H20+2e-S2042-+0H0°=-1.12
① 还原性(为主) H2O+SO3 2-+Cl2→SO4 2-+Cl-+H+ 氧化:H ++SO3 2-+H2S→S↓+H2O Na2S2O4 强还原剂 2SO3 2-+2H2O+2e—S2O4 2-+OH- =-1.12

②不稳定性 S2042-+H20→S2032-+HS03 S2032+Ht→S↓+S02↑ S032+H+→H20+S02↑ S2032+12→S4062 S2032+Cl2→S04 ③ 氧化性:H2S04(浓)、K2S2O8
② 不稳定性 S2O4 2-+H2O→S2O3 2-+HSO3 - S2O3 2-+H+→S↓+SO2↑ SO3 2-+H+→ H2O +SO2↑ S2O3 2-+I2→S4O6 2- S2O3 2-+Cl2→SO4 2- ③ 氧化性:H2SO4(浓)、K2S2O8

Se、Te H2SeO3+H+4e Se+H200°=0.74 Se042-+H++2e-H2Se03+H20 0°=1.15 S042-+H++2e-H2S03+H20 0°=0.17 H6TeO6无色晶体 弱酸
Se、Te H2SeO3+H ++4e ——Se+H2O =0.74 SeO4 2-+H ++2e ——H2SeO3+H2O =1.15 SO4 2-+H ++2e ——H2SO3+H2O =0.17 H6TeO6无色晶体 弱酸
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十二章 卤素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十一章 氧化还原反应.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十章 电解质溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第九章 配位平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第八章 化学平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第七章 缓冲溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第六章 化学热力学初步.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第五章 电化学与金属腐蚀.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第四章 化学键与分子结构(离子键理论).ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第三章 原子结构(原子核外电子运动状态).ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二章 物质状态.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第一章 热化学与能源.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)绪论.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第八章 表面化学和胶体化学.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第十章 统计热力学基础 §3 子配分函数的计算 §4 相倚子体系与系综原理.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第十章 统计热力学基础 §1 统计热力学预备知识 §2 近独立子体系的统计规律.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第九章 相律与相图(9.9)三元系相图简介.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第九章 相律与相图(9.1-9.8).ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第五章 电解质溶液.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第七章 电极过程.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十四章 氮族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十五章 碳族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十六章 硼族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十七章 碱金属和碱土金属.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十八章 铜、锌副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十章 过渡金属(I)§20.1 概述 §20.2 Ti副族 §20.3 钒副族 §20.4 铬副族 §20.5 锰副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十一章 过渡金属(Ⅱ)§21.1 铁系元素 §21.2 铂系元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十二章 稀土元素.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第二章 化学键与化学结构 Chemical Bond And Molecular Structure.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第三章 化学反应速率与反应动力学的初步概念 Primary Conception of Chemical Reaction Rate and Reaction Kinetics.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第四章 化学热力学的初步概念与化学平衡 Primary Conception of Chemical Thermodynamics & Chemical Equilibrium.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第六章 电解质溶液和非电解质溶液 Electrolyte Solution and Non Electrolyte Solution.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第七章 氧化还原反应 Oxidation-reduction reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第八章 配位化合物 Coordination Compounds.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十章 p区元素 p-block elements(一).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十一章 p区元素 p Block Elements(二).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十二章 d区元素 d-Blocks Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十三章 f区元素 f-Block Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)绪论 Inorganic Chemistry(主讲:刘洪).ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
