福州大学:《大学基础化学》课程教学课件(PPT讲稿)第五章 电化学与金属腐蚀

第5章电化学与金属腐蚀 §5.1原电池 一、组成和反应 1.化学能转化为电 能的装置 细11-1 頜钟原电格
第5章 电化学与金属腐蚀 §5.1原电池 一、组成和反应 1.化学能转化为电 能的装置

能自发进行的反应才具有能量,即△G<O的反 应; ■可利用的最大化学能等于△G的数值: 电功(非体积功)Wmax=一△G. a 电池反应一般是一氧化还原反应: Zn+Cu2+(aq)Zn2+(aq)+Cu 标态下,298K时△rG=△fGzn2+-△fGcu2+ =-147.06-65.249=-212.31kJ.mo1
◼ 能自发进行的反应才具有能量,即ΔG<0的反 应; ◼ 可利用的最大化学能等于ΔG的数值: 电功(非体积功)Wmax=-ΔG. ◼ 电池反应一般是一氧化还原反应: Zn+ Cu2+(aq)←→Zn2+(aq)+ Cu 标态下,298K时ΔrGø= ΔfGø Zn2+- ΔfGø Cu2+ =-147.06-65.249=-212.31kJ.mol-1

2.电池反应和电极反应 电池反应一般是一氧化还原反应 Zn+Cu2+(aq)Zn2+(aq)+Cu 分为两个半反应:氧化半反应Zn→Zn2+(aq)+2e 还原半反应Cu2+(aq)+2e→Cu ■电池负极(一)输出电子,即失电子的反应 (-)Zn→Zn2+(aq)+2e ■电池正极(+)得到电子的反应 (+)Cu2+(aq)+2e→Cu 两个电极反应相加就是电池反应
2.电池反应和电极反应 ◼ 电池反应一般是一氧化还原反应 Zn+ Cu2+(aq)←→Zn2+(aq)+ Cu 分为两个半反应:氧化半反应Zn →Zn2+(aq)+2e 还原半反应Cu2+(aq) +2e→ Cu ◼ 电池负极(-)输出电子,即失电子的反应 (-) Zn →Zn2+(aq)+2e ◼ 电池正极(+)得到电子的反应 (+) Cu2+(aq) +2e→ Cu 两个电极反应相加就是电池反应

注意电极反应就是半反应,有关某个元 素的得或失电子的反应;同样需要配平。 ■Mn04-→Mn2+ Mn04-+5e→Mn2+ MnO+8H++5e Mn2++4H2O 配平要注意:酸性介质H+一H20, 碱性介质用OH一H,O
◼ 注意电极反应就是半反应,有关某个元 素的得或失电子的反应;同样需要配平。 ◼ MnO4 -→ Mn2+ ? MnO4 -+5e → Mn2+ MnO4 -+8H++5e = Mn2++4H2O 配平要注意:酸性介质H+-H2O, 碱性介质用OH--H2O
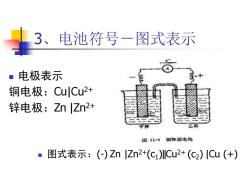
3、电池符号一图式表示 ■电极表示 铜电极:CuCu2+ 锌电极:Zn|Zn2+ 母11-1细钟原电悦 ■图式表示:(-)Zn|Zn2+(c1)Cu2+(c2)ICu(+)
3、电池符号-图式表示 ◼ 电极表示 铜电极:Cu|Cu2+ 锌电极:Zn |Zn2+ ◼ 图式表示:(-) Zn |Zn2+(c1 )‖Cu2+ (c2 ) |Cu (+)

几种不同电极的表示 氧化态还原态均为溶液:Fe3++e-=Fe2+ 要加惰性电极,如Pt,c等:PtFe2+,Fe3+ ■有气体参与反应:2H十+2e=H2 也要加惰性电极:(Pt)H2H(C) ·有沉淀参与反应:AgC+e=Ag+C Ag|AgCl,Cl(c)
◼ 氧化态还原态均为溶液:Fe3+ + e- =Fe2+ 要加惰性电极,如Pt,C等:Pt |Fe2+ , Fe3+ ◼ 有气体参与反应:2H++2e=H2 也要加惰性电极: (Pt) H2 |H+ (c) 几种不同电极的表示 ◼ 有沉淀参与反应:AgCl+ e=Ag+ Cl- Ag|AgCl,Cl-(c)

整反应→两个半反应一→图式表示 ←一(电极反应)←一 ■Cr20,2-+6fFe2++14H+=2Cr3++6fe3++7H20 (+)Cr2072-+14H++6e=2Cr3++7H20 (-)Fe2+-e=Fe3+ (-)Pt]Fe2+,Fe3+Cr3+,Cr2O-Pt (+ ■(-)(C)I2lI-(c)lFe2+(c2),Fe3+(c3)|C(+) +Fe3++e =Fe2+ -)2I=I2+2e 总反应:2Fe3++2I-=2Fe2++I2
整反应→两个半反应→图式表示 ←(电极反应) ← ◼ Cr2O7 2-+6Fe2++14H+=2Cr3++6Fe3++7H2O (+) Cr2O7 2- +14H++6e = 2Cr3+ +7H2O (-) Fe2+-e = Fe3+ (-)Pt|Fe2+ , Fe3+‖ Cr3+ , Cr2O7 2- | Pt (+) ◼ (-) (C) I2|I- (c1 ) ‖ Fe2+ (c2 ), Fe3+ (c3 ) | C (+) +) Fe3+ + e =Fe2+ -) 2I-=I2+ 2e 总反应:2Fe3+ + 2I- =2Fe2+ + I2
二、反应△G与电池电动势关系 Zn+Cu2+(aq)-Zn2+(aq)+Cu 标态下,△rG9=△fG°Zn2+-△fGcu2+ 298K时 =-147.06-65.249=-212.31kJ.mo1 m电功(非体积功)Wmax=一△G
二、反应ΔrG 与电池电动势关系 Zn+ Cu2+(aq)←→Zn2+(aq)+ Cu 标态下,ΔrGø= ΔfGø Zn2+- ΔfGø Cu2+ 298K时 =-147.06-65.249=-212.31kJ.mol-1 ◼ 电功(非体积功)Wmax=-ΔG

1.Nernst方程 电功W=IVt=电量电压 =n×6.023×1023×1.602×10-19×E =n X96485 XE=nFE -△rG=nFE 标态下反应:一△rGo=nFEo △rG=△rGo+RT·lnQ E=E0-RT/nF .InQ E=E0-0.0592/nlgQ
-ΔrG =nFE 电功W=I·V·t=电量•电压 =n× 6.023 ×1023 ×1.602 ×10-19 ×E =n ×96485 ×E=nFE 标态下反应:-ΔrG ø =nFE ø ΔrG = ΔrG ø+RT ·lnQ E = E ø-RT/nF ·lnQ E = E ø-0.0592/n ·lgQ 1.Nernst方程

2.反应平衡常数与电池标准电动势的关系 △rG0=-nFE0 同时,△rGg=一RT.InK InK o = nFE nE Ig K= RT 0.0592
ΔrG ø = - nFE ø 同时, ΔrG ø = -RT·lnK ø lnK ø = 2.反应平衡常数与电池标准电动势的关系 0.0592 lg o o o nE K RT nFE =
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第四章 化学键与分子结构(离子键理论).ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第三章 原子结构(原子核外电子运动状态).ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二章 物质状态.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第一章 热化学与能源.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)绪论.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第八章 表面化学和胶体化学.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第十章 统计热力学基础 §3 子配分函数的计算 §4 相倚子体系与系综原理.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第十章 统计热力学基础 §1 统计热力学预备知识 §2 近独立子体系的统计规律.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第九章 相律与相图(9.9)三元系相图简介.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第九章 相律与相图(9.1-9.8).ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第五章 电解质溶液.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第七章 电极过程.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §4. 熵(S)及其应用 §5. 自由能A和G.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §3.热化学——化学反应过程的△U和△H.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §1. 化学热力学的科学框架 §2. 热力学能(U)和焓(H).ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第六章 可逆原电池.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第三章 化学平衡热力学原理.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第四章 化学动力学 §4 活化能与元反应速率理论简介 §5 液相反应和多相反应动力学分析 §6 催化反应动力学 §7 反应速率的实验测定原理与方法.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第四章 化学动力学 §1 化学动力学的任务与概况 §2 动力学方程式 §3 典型复杂反应动力学分析.ppt
- 四川大学:《物理化学》课程教学资源(课件讲稿)绪论.pdf
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第六章 化学热力学初步.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第七章 缓冲溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第八章 化学平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第九章 配位平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十章 电解质溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十一章 氧化还原反应.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十二章 卤素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十三章 氧族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十四章 氮族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十五章 碳族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十六章 硼族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十七章 碱金属和碱土金属.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十八章 铜、锌副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十章 过渡金属(I)§20.1 概述 §20.2 Ti副族 §20.3 钒副族 §20.4 铬副族 §20.5 锰副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十一章 过渡金属(Ⅱ)§21.1 铁系元素 §21.2 铂系元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十二章 稀土元素.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第二章 化学键与化学结构 Chemical Bond And Molecular Structure.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第三章 化学反应速率与反应动力学的初步概念 Primary Conception of Chemical Reaction Rate and Reaction Kinetics.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第四章 化学热力学的初步概念与化学平衡 Primary Conception of Chemical Thermodynamics & Chemical Equilibrium.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第六章 电解质溶液和非电解质溶液 Electrolyte Solution and Non Electrolyte Solution.ppt
