福州大学:《大学基础化学》课程教学课件(PPT讲稿)第一章 热化学与能源

第1章热化学与能源 §1.1反应热 一、热力学中几个基本概念 体系和环境:热力学中研究的对象为体系 称体系以外的其他部分为环境 状态和状态函数 过程和途径可逆过程 4. 化学计量数和反应进度
第1章 热化学与能源 • §1.1 反应热 一、热力学中几个基本概念 1. 体系和环境 :热力学中研究的对象为体系, 称体系以外的其他部分为环境. 2. 状态和状态函数 3. 过程和途径 可逆过程 4. 化学计量数和反应进度

N2(g)+3H2(g)=2NH3(g) 各计量数v(N2)=-1 v(H2)=-3 v(NH3)=2 反应进度ξ,单位是mol 如上述反应消耗了1.5molN24.5molH2 生成了3mol的NH3 则该反应进度为=-1.5mol/-1 =-4.5mol/-3 =3 mol/2 1.5mol
N2 (g) + 3H2 (g) = 2NH3 (g) • 各计量数 ( N2)= -1 ( H2)= -3 ( NH3)= 2 • 反应进度 ,单位是mol 如上述反应消耗了1.5mol N2 4.5molH2 生成了3 mol的NH3 则该反应进度为=- 1.5mol /-1 = - 4.5mol/-3 = 3 mol/2 = 1.5mol

注意:对不同反应式有不同的进度;如 同样反应消耗1.5molN2对上述反应进度 为1.5mol,但对于 下式反应1/2N2(g)+3/2H2(g)=NH(g) 反应进度为3mol
• 注意:对不同反应式有不同的进度;如 同样反应消耗1.5mol N2对上述反应进度 为1.5mol,但对于 • 下式反应 1/2N2(g) + 3/2H2(g) = NH3(g) 反应进度为3 mol

反应热的测量, Q或q表示热量,单位用J(焦耳) 、 kJ(千焦) 系统放出热量,则q为负值;系统吸 收环境的热量,则q为正值 装置图P12图1.2 一般用已知燃烧热的样品测试量热计的热 容C:q(已知)=-C。△T C含水的总热容和仪器的热容 (未知)=-C·△T9
反应热的测量, • Q或q 表示热量,单位用J(焦耳)、 kJ(千焦) 系统放出热量,则q 为负值;系统吸 收环境的热量,则q为正值 • 装置图P12 图1.2 一般用已知燃烧热的样品测试量热计的热 容C:q(已知)=-C• T C含水的总热容和 仪器的热容 q (未知)= -C• T ‘

§1.2反应热理论计算 一、 热力学第一定律 、 能量守恒定律 2、焓的定义 3、 qv与qp差别 4、反应热的表示 5、 盖斯定律
§1.2 反应热理论计算 • 一、热力学第一定律 1、能量守恒定律 2、焓的定义 3、qv与qp差别 4、反应热的表示 5、盖斯定律

二、标准摩尔生成焓 在温度T、标准压力p°(100kPa))下 由稳定单质生成1mol某物质时,所产生的 反应热就叫该物质的标准摩尔生成热,单 位:k.mol1,符号△Hm° 注:稳定单质?对于存在多种单质形式的有特 指,如磷指白磷,碳指石墨等。 该温度、压力下的稳定状态:如书中数据常是 标准压力、298K的数据。该条件下氯的稳定状 态是C2(g),而不是C2(I);溴是Br2(1), 而不是Br2(g);碘是12(s),而不是2(I)
• 二、标准摩尔生成焓 在温度T、标准压力p (100kPa) )下, 由稳定单质生成1mol某物质时,所产生的 反应热就叫该物质的标准摩尔生成热,单 位:kJ.mol-1 ,符号fH m • 注:稳定单质?对于存在多种单质形式的有特 指,如磷指白磷,碳指石墨等。 该温度、压力下的稳定状态:如书中数据常是 标准压力、298K的数据。该条件下氯的稳定状 态是Cl2(g),而不是Cl2(l);溴是Br2( l ), 而不是Br2( g );碘是I2(s),而不是I2(l);
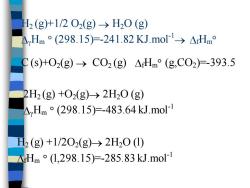
12(g+1/202(g)→H20(g) AyHm°(298.15)=-241.82KJ.mol→△fHm C(s+02(g)→C02(g)△Hm°(g,C02)=-393.5 2H2(g)+O2(g)→2H20(g) Hm°(298.15)=-483.64kJ.mol1 H2(g)+1/202(g)→2H20(I) △Hm°(L,298.15)=-285.83kJ.mol
H2 (g)+1/2 O2(g) → H2O (g) Hm (298.15)=-241.82 KJ.mol-1→ fHm C (s)+O2(g) → CO2 (g) fHm (g,CO2)=-393.5 2H2 (g) +O2(g)→ 2H2O (g) Hm (298.15)=-483.64 kJ.mol-1 H2 (g) +1/2O2(g)→ 2H2O (l) fHm (l,298.15)=-285.83 kJ.mol-1

有了标准生成焓数据,任意反应即可查表计算反 应热。 如:4NH3(g)+5O2(g)→4NO(g)+6H2O(g) 查表:△Hm°(NH3,g)=-46.11kJ.mo △fHm°(NO,g)=90.25kJ.mol1 △Hm°(H20,g)=-241.82kJ.mol △rHm°=4△Hm°(NO,g)+6△Hm°(H0,g)- 4△Hm°(NH,g) =4×90.25+6×(-241.82)-4×(-46.11) =-905.48kJ.mo
• 有了标准生成焓数据,任意反应即可查表计算反 应热。 如 : 4NH3 (g) +5 O2 (g) → 4NO(g) + 6H2O(g) • 查表:fHm (NH3,g)=-46.11 kJ.mol-1 fHm (NO,g)=90.25kJ.mol-1 fHm (H2O,g)=-241.82 kJ.mol-1 rHm =4fHm (NO,g)+6fHm (H2O,g) - 4fHm (NH3,g) =4×90.25+ 6×(-241.82)-4×(-46.11) =-905.48 kJ.mol-1

三、从其它数据计算反应热 ■1.从燃烧热△cHm°计算 CH3OH0+O2→C02+2H20△cHm°=-726.6 CH20(g)+02→C02+H20△cHm°=-563.6 CHgOH(I)+Oz>CHzO(g)+H2O ( △rHm°=-726.6-(-563.6)=-163.0kJmo1
三、从其它数据计算反应热 ◼ 1.从燃烧热cm 计算 CH3OH(l) + O2→ CO2 + 2H2O cm =-726.6 CH2O(g) + O2→ CO2 + H2O cm =-563.6 CH3OH(l) + O2→ CH2O(g) +H2O (l) rm = -726.6-(-563.6)=-163.0 kJ·mol-1 2 1

■2.从键能估算反应热 H H C=( →H O H H H HH Ec=c=602,E0-H=458.8,Ec-H=411 Ec-c=345.6,Ec-o=357.7kJmo1 △rHm°=4Ec-H+1XEc=c+2XEo-H -[5EcH+1×Ec-c+1×Ec-o+1×Eo.H Ec=c+Eo-H-EC-H-Ec-c-Ec-o =602+459-411-346-358 =-54 kJ.mol-1
◼ 2.从键能估算反应热 Ec=c=602 ,EO-H=458.8,EC-H=411 Ec-c=345.6,Ec-o=357.7 kJ·mol-1 rm =4 EC-H +1× Ec=c +2× EO-H -[5 EC-H + 1× Ec-c + 1× Ec-o + 1× EO-H] = Ec=c+ EO-H - EC-H - Ec-c- Ec-o =602+459-411-346-358 =-54 kJ·mol-1
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)绪论.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第八章 表面化学和胶体化学.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第十章 统计热力学基础 §3 子配分函数的计算 §4 相倚子体系与系综原理.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第十章 统计热力学基础 §1 统计热力学预备知识 §2 近独立子体系的统计规律.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第九章 相律与相图(9.9)三元系相图简介.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第九章 相律与相图(9.1-9.8).ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第五章 电解质溶液.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第七章 电极过程.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §4. 熵(S)及其应用 §5. 自由能A和G.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §3.热化学——化学反应过程的△U和△H.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §1. 化学热力学的科学框架 §2. 热力学能(U)和焓(H).ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第六章 可逆原电池.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第三章 化学平衡热力学原理.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第四章 化学动力学 §4 活化能与元反应速率理论简介 §5 液相反应和多相反应动力学分析 §6 催化反应动力学 §7 反应速率的实验测定原理与方法.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第四章 化学动力学 §1 化学动力学的任务与概况 §2 动力学方程式 §3 典型复杂反应动力学分析.ppt
- 四川大学:《物理化学》课程教学资源(课件讲稿)绪论.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第四章 化学反应动力学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第六章 电化学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第八章 胶体化学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第五章 相平衡热力学.pdf
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二章 物质状态.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第三章 原子结构(原子核外电子运动状态).ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第四章 化学键与分子结构(离子键理论).ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第五章 电化学与金属腐蚀.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第六章 化学热力学初步.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第七章 缓冲溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第八章 化学平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第九章 配位平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十章 电解质溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十一章 氧化还原反应.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十二章 卤素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十三章 氧族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十四章 氮族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十五章 碳族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十六章 硼族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十七章 碱金属和碱土金属.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十八章 铜、锌副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十章 过渡金属(I)§20.1 概述 §20.2 Ti副族 §20.3 钒副族 §20.4 铬副族 §20.5 锰副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十一章 过渡金属(Ⅱ)§21.1 铁系元素 §21.2 铂系元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十二章 稀土元素.ppt
