广东工业大学:《物理化学》课程教学资源(PPT课件)第五章 电解质溶液

第五章 电解质溶液
电 解 质 溶 液 第 五 章

§1引言 电子得失,电荷的传递和转移:电能→化学能 规律 条件 电极:金属类导体/电解质溶液 金属类导体的导电规律一, 物理学 电解质溶液的导电规律 原电池 电解池 界面电化学反应的规律 电化学 电极过程 氧化还原反应:得电子被还原,失电子被氧化
§1 引 言 电能 化学能 规律 条件 电极:金属类导体 / 电解质溶液 金属类导体的导电规律 —— 物理学 电子得失,电荷的传递和转移: 氧化/还原反应:得电子被还原,失电子被氧化 电解质溶液的导电规律 界面电化学反应的规律 电化学 原电池 电解池 电极过程

第1节引言 第2节 氧化还原反应的基本知识 第3节 原电池和电解池 第4节1 电解质溶液的电导 第5节1 离子淌度和离子迁移数 第6节 强电解质溶液的活度及活度系数 第7节电解质溶液理论简介
第3节 原电池和电解池 第4节 电解质溶液的电导 第5节 离子淌度和离子迁移数 第6节 强电解质溶液的活度及活度系数 第7节 电解质溶液理论简介 第2节 氧化还原反应的基本知识 第1节 引言

§2氧化还原反应的基本知识 氧化赵 氧化数(也称氧化态或氧化值): 指化合物分子中某元素一个原子的表观电 荷数。这种电荷数是将化合物中成键的电子都 归为电负性更大的原子一方而定义的。 规则:1.习惯规定:教材P421①,②,③,④
§2 氧化还原反应的基本知识 一 、氧化数 氧化数(也称氧化态或氧化值): 指化合物分子中某元素一个原子的表观电 荷数。这种电荷数是将化合物中成键的电子都 归为电负性更大的原子一方而定义的。 规则:1.习惯规定:教材P421 ①,②,③,④

2.简单离子化合物中,元素原子的氧化数为 相应离子的正、负电荷数。 3.共价化合物中,元素的氧化数等于其电子 偏移个数,电负性大的元素的氧化数为负, 电负性小要氧化数为正。 4.结构未知的化合物中,某元素的氧化数可 按如下规则求得:中性分子中各元素氧化 数的代数和等于零;复杂离子中各元素氧 化数的代数和等于该离子的电荷数
2. 简单离子化合物中,元素原子的氧化数为 相应离子的正、负电荷数。 3. 共价化合物中,元素的氧化数等于其电子 偏移个数,电负性大的元素的氧化数为负, 电负性小要氧化数为正。 4. 结构未知的化合物中,某元素的氧化数可 按如下规则求得:中性分子中各元素氧化 数的代数和等于零;复杂离子中各元素氧 化数的代数和等于该离子的电荷数

例:K2MnO4、KMnO4、Cr20,2、HC1O中各原 子的氧化数各为多少? 化合价:整数 氧化数:整数、分数,可能超过化合价的值。 决定电子得失数,如:Fe3O4一FeO Fe:+(8/3)→+2,(83)-2=23,3×(23)=2 Fe304+2e+2H+==3Fe0+H0 氧化数高的状态:氧化态 氧化数低的状态:还原态
例:K2MnO4、KMnO4、Cr2O7 2-、HClO中各原 子的氧化数各为多少? 化合价:整数 氧化数:整数、分数,可能超过化合价的值。 决定电子得失数,如:Fe3O4→ FeO Fe:+(8/3) → +2 , (8/3) -2 = 2/3 , 3×(2/3) = 2 Fe3O4 + 2e - + 2H+ === 3FeO +H2O 氧化数高的状态:氧化态 氧化数低的状态:还原态
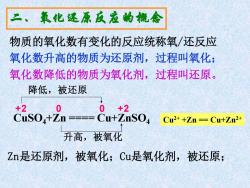
二、氧化还原反孟的橇念 物质的氧化数有变化的反应统称氧/还反应 氧化数升高的物质为还原剂,过程叫氧化; 氧化数降低的物质为氧化剂,过程叫还原。 降低,被还原 品s0+n—8u+孟so Cu2++Zn =Cu+Zn2+ 升高,被氧化 Zn是还原剂,被氧化;Cu是氧化剂,被还原;
CuSO4+Zn ==== Cu+ZnSO4 +2 0 0 +2 降低,被还原 升高,被氧化 二、氧化还原反应的概念 物质的氧化数有变化的反应统称氧/还反应 氧化数升高的物质为还原剂,过程叫氧化; 氧化数降低的物质为氧化剂,过程叫还原。 Zn是还原剂,被氧化;Cu是氧化剂,被还原; Cu2+ +Zn == Cu+Zn2+

三、氧化还原友方程式的配平 原则:物质守恒,电荷守恒 1.氧化数法:熟悉 2.离子-电子法:分别配平氧化、还原反应 对于水溶液反应的配平问题: 若方程式两边的电荷无法平衡时,可以 用H或OH补充! 对于氧化数法难以配平的反应,离子-电子法 可能比较方便
三、氧化还原反应方程式的配平 1. 氧化数法:熟悉 2. 离子-电子法:分别配平氧化、还原反应 对于水溶液反应的配平问题: 若方程式两边的电荷无法平衡时,可以 用H+或OH-补充! 对于氧化数法难以配平的反应,离子-电子法 可能比较方便。 原则:物质守恒,电荷守恒

例 离子·电子法配平碱液吸收氯气的反应 方程式。 (1)写出离子反应式: Cl2+OH→CI03+C (2)将反应写成两个半反应: 氧化反应:C2+OH→C1O3 还原反应:C2→C (3)配平半反应两端的原子数和电荷数: 0.5C2+60H→CI03+5e+3H20 0.5Cl2+e→C
例 离子-电子法配平碱液吸收氯气的反应 方程式。 (1)写出离子反应式: Cl2 + OH- →ClO3 - + Cl- (2)将反应写成两个半反应: 氧化反应: Cl2 + OH- →ClO3 - 还原反应: Cl2 → Cl- (3)配平半反应两端的原子数和电荷数: 0.5Cl2 + 6OH- →ClO3 - + 5e - + 3H2O 0.5 Cl2 + e- → Cl-

(4)根据得失电子数相等原则,配平两个 半反应,并合并为一个离子方程式: 0.5CL2+60H→C103+5e+3H20 ×1 +)0.5Cl2+e→C ×5 Cl2+60H→CI103+5C+3H20 (5)改写成分子方程式: Cl,6NaOH===NaCIO3+5NaCI 3H,O 配半反应式两边氧原子数不等时: 酸性介质中,在多氧的一边加H+,少氧的一边加水: 巧 碱性介质中,在多氧的一边加水,少氧的一边加水H+
(4)根据得失电子数相等原则,配平两个 半反应,并合并为一个离子方程式: (5)改写成分子方程式: ×1 ×5 0.5Cl2 + 6OH- →ClO3 - + 5e- + 3H2O 0.5Cl2 + e- → Cl- +) Cl2 + 6OH- →ClO3 - + 5Cl- + 3H2O Cl2 + 6NaOH === NaClO3 + 5NaCl + 3H2O 配 平 技 巧 半反应式两边氧原子数不等时: 酸性介质中,在多氧的一边加H+ ,少氧的一边加水; 碱性介质中,在多氧的一边加水,少氧的一边加水H+
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第七章 电极过程.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §4. 熵(S)及其应用 §5. 自由能A和G.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §3.热化学——化学反应过程的△U和△H.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §1. 化学热力学的科学框架 §2. 热力学能(U)和焓(H).ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第六章 可逆原电池.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第三章 化学平衡热力学原理.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第四章 化学动力学 §4 活化能与元反应速率理论简介 §5 液相反应和多相反应动力学分析 §6 催化反应动力学 §7 反应速率的实验测定原理与方法.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第四章 化学动力学 §1 化学动力学的任务与概况 §2 动力学方程式 §3 典型复杂反应动力学分析.ppt
- 四川大学:《物理化学》课程教学资源(课件讲稿)绪论.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第四章 化学反应动力学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第六章 电化学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第八章 胶体化学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第五章 相平衡热力学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第三章 化学反应热力学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第七章 表面化学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第一章 热力学基础.pdf
- 《物理化学》课程教学课件(PPT讲稿)第九章 表面与胶体化学(图片版,2/2).ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 表面与胶体化学(图片版,1/2).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(6/6).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(5/6).ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第九章 相律与相图(9.1-9.8).ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第九章 相律与相图(9.9)三元系相图简介.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第十章 统计热力学基础 §1 统计热力学预备知识 §2 近独立子体系的统计规律.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第十章 统计热力学基础 §3 子配分函数的计算 §4 相倚子体系与系综原理.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第八章 表面化学和胶体化学.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)绪论.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第一章 热化学与能源.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二章 物质状态.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第三章 原子结构(原子核外电子运动状态).ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第四章 化学键与分子结构(离子键理论).ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第五章 电化学与金属腐蚀.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第六章 化学热力学初步.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第七章 缓冲溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第八章 化学平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第九章 配位平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十章 电解质溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十一章 氧化还原反应.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十二章 卤素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十三章 氧族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十四章 氮族元素.ppt
