广东工业大学:《物理化学》课程教学资源(PPT课件)第七章 电极过程

的 电极过程
第七章 电 极 过 程

§1.引言 一、电极过程中的电极过程步骤 (1),(2), (3),(4),(5) (3)—电化学反应,其余一 次级反应 电极过程特征: ①电极电势影响反应速率 电极对反应有催化作用(加速或减速) 墨 形状、大小、性质等均有影响
§1. 引 言 (1), (2), (3), (4), (5) (3)——电化学反应,其余—— 次级反应 电极过程特征: ① 电极电势影响反应速率 ② 电极对反应有催化作用(加速或减速), 形状、大小、性质等均有影响 一、电极过程中的电极过程步骤

电极反应速率的表示 1 dn I△t r= 而△n= A dt F zF 1 故r= 即roci A F 所以, 实际中以电流密度i表示电极反应速率 三、不可逆电极电势 还原电流密度 电极反应:M++e= M 氧化电流密度
二、电极反应速率的表示 t n A r d 1 d s = 而 zF I t zF Q n = = 故 zF i zF I A r = = s 1 即 r i 所以,实际中以电流密度 i 表示电极反应速率 三、不可逆电极电势 电极反应: - M ze z + + M ic ia 氧化电流密度 还原电流密度

电池或电极处于平衡状态 (可逆):r=ra 即i。=i,此时令。=i=”,称为交换电流密度 通过电极(池)的净电流为零,即i=。一il=0。 实际电极过程,i卡0,即i卡ia,电极的工作 条件不可逆→不可逆电极→不可逆电极电势。 E±,不可逆≠E±,可逆造成这一结果的因素有多种, 如杂质反应等。(见P511) 实际电势偏离平衡电势的现象一 电极极化 图
电池或电极处于平衡状态(可逆): rc = ra, 即 i c = ia,此时令i c = ia = i 0 ,称为交换电流密度 通过电极(池)的净电流为零,即 i = |i c- ia | =0。 实际电极过程,i ≠0,即 i c ≠ia,电极的工作 条件不可逆→不可逆电极→不可逆电极电势。 E±,不可逆≠ E±, 可逆造成这一结果的因素有多种, 如杂质反应等。(见P511) 实际电势偏离平衡电势的现象—— 电极极化
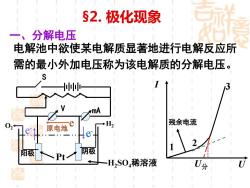
§2.极化现象 一、分解电压 电解池中欲使某电解质显著地进行电解反应所 需的最小外加电压称为该电解质的分解电压。 mA 02 残余电流 原电池 阳极 阴极 Pt 一H,S04稀溶液 0分
§2. 极化现象 一、分解电压 电解池中欲使某电解质显著地进行电解反应所 需的最小外加电压称为该电解质的分解电压。 S V mA H2SO4稀溶液 Pt O2 阴极 e - 原电池 e - e I U 1 2 3 U分 H2 残余电流 阳极

U-Emat=IR,I=0时,U=Emax 理论分解电压 实际分解电压一U分>Emx→极化 二、析出电势与溶解电势 电极反应析出单质物质的有: 阴极—析出金属、H2.阳极—析出02、C2 析出电势 实际在电极上能显著析出单质物 质的最小电极电势。 阳极反应使阳极金属溶解为金属离子对应的 溶解电势 实际在电极上能显著使阳极溶解 的最小电势
U-Emax =IR,I = 0时,U =Emax——理论分解电压 实际分解电压——U分> Emax →极化 二、析出电势与溶解电势 电极反应析出单质物质的有: 阴极——析出金属、H2, 阳极——析出O2、Cl2 析出电势 —— 实际在电极上能显著析出单质物 质的最小电极电势。 阳极反应使阳极金属溶解为金属离子对应的 溶解电势 —— 实际在电极上能显著使阳极溶解 的最小电势

理论上,析出电势(或溶解电势)=可逆电极电势 实际上,析出电势(或溶解电势)≠可逆电极电势 这种现象一极化→实际电势≠可逆电势 析出电势或溶解电势都与电极反应本性、电极反 应的作用物、产物浓度(分压)、温度、电极金 属导体材料性质、电极极化的难易程度有关。 利用E析出或E溶解不同,可控制复杂电化学体系中 先析出或先溶解的物质,以达到分离的目的
理论上,析出电势(或溶解电势) = 可逆电极电势 实际上,析出电势(或溶解电势) ≠ 可逆电极电势 这种现象 —— 极化 →实际电势≠可逆电势 析出电势或溶解电势都与电极反应本性、电极反 应的作用物、产物浓度(分压)、温度、电极金 属导体材料性质、电极极化的难易程度有关。 利用E析出或E溶解不同,可控制复杂电化学体系中, 先析出或先溶解的物质,以达到分离的目的

三、超电势与极化曲线 在一定的电流密度下,实际电极电势与可逆电极 电势差值的绝对值一超电势: 门=|E电极(实际)一E电极(何逆|>0 刀个,电极极化程度个 刀正值 实验表明: 阳极极化使阳极实际电势比平衡电势更正 阴极极化使阴极实际电势比平衡电势更负
三、超电势与极化曲线 在一定的电流密度下,实际电极电势与可逆电极 电势差值的绝对值 —— 超电势: η= | E电极(实际) - E电极(可逆) | > 0 η↑,电极极化程度↑ η正值 实验表明: 阳极极化使阳极实际电势比平衡电势更正 阴极极化使阴极实际电势比平衡电势更负
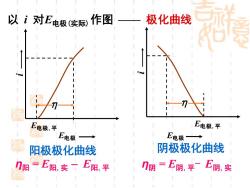
以i对E电极实际) 作图—一极化曲线 E电极,平 E电极,平 E电极 E电极→ 阳极极化曲线 阴极极化曲线 η阳 =E阳.实一E阳,平 门阴=E阴,平E阴,实
以 i 对E电极(实际)作图 —— 极化曲线 阳极极化曲线 阴极极化曲线 E电极,平 η i E电极 E电极,平 η i E电极 η阳 = E阳,实 – E阳,平 η阴 = E阴,平- E阴,实

四、电解池和原电池的极化现象 原则:阳极极化曲线:i↑,E电极向正向移动 阴极极化曲线:i↑,E电极向负向移动 电解池: U分=E可逆+△E不可逆+IR ≈E可逆十△E不可逆 U外 △E不阿逆=几阳+几阴 : 7阴 阳 E可逆=E+,平E,平=E阳,平E阴,平 E可 E阴,平 E阳,平 U分=E阳,平-E阴,平+门阳+门阴 E- =E阳一E阴 i↑,门阳f,I阴t 超 U分>E可逆
四、电解池和原电池的极化现象 原则:阳极极化曲线: i↑,E电极 向正向移动 阴极极化曲线: i↑,E电极 向负向移动 电解池: U分 = E可逆+ △E不可逆 + IR ≈ E可逆+ △E不可逆 △E不可逆 = η阳 + η阴 E可逆 = E+,平-E-,平= E阳,平-E阴,平 U分 = E阳,平-E阴,平+η阳 + η阴 = E阳-E阴 E E可逆 U外 阴 阳 E阴,平 E阳,平 i i↑,η阳↑,η阴↑ U分 > E可逆
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §4. 熵(S)及其应用 §5. 自由能A和G.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §3.热化学——化学反应过程的△U和△H.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第一章 化学热力学基本定律与函数 §1. 化学热力学的科学框架 §2. 热力学能(U)和焓(H).ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第六章 可逆原电池.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第三章 化学平衡热力学原理.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第四章 化学动力学 §4 活化能与元反应速率理论简介 §5 液相反应和多相反应动力学分析 §6 催化反应动力学 §7 反应速率的实验测定原理与方法.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第四章 化学动力学 §1 化学动力学的任务与概况 §2 动力学方程式 §3 典型复杂反应动力学分析.ppt
- 四川大学:《物理化学》课程教学资源(课件讲稿)绪论.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第四章 化学反应动力学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第六章 电化学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第八章 胶体化学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第五章 相平衡热力学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第三章 化学反应热力学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第七章 表面化学.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第一章 热力学基础.pdf
- 《物理化学》课程教学课件(PPT讲稿)第九章 表面与胶体化学(图片版,2/2).ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 表面与胶体化学(图片版,1/2).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(6/6).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(5/6).ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 电化学(4/6).ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第五章 电解质溶液.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第九章 相律与相图(9.1-9.8).ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第九章 相律与相图(9.9)三元系相图简介.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第十章 统计热力学基础 §1 统计热力学预备知识 §2 近独立子体系的统计规律.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第十章 统计热力学基础 §3 子配分函数的计算 §4 相倚子体系与系综原理.ppt
- 广东工业大学:《物理化学》课程教学资源(PPT课件)第八章 表面化学和胶体化学.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)绪论.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第一章 热化学与能源.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二章 物质状态.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第三章 原子结构(原子核外电子运动状态).ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第四章 化学键与分子结构(离子键理论).ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第五章 电化学与金属腐蚀.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第六章 化学热力学初步.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第七章 缓冲溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第八章 化学平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第九章 配位平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十章 电解质溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十一章 氧化还原反应.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十二章 卤素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十三章 氧族元素.ppt
