西北大学:《普通化学》课程教学资源(PPT课件)第三章 化学反应速率与反应动力学的初步概念 Primary Conception of Chemical Reaction Rate and Reaction Kinetics

第3章 化学反应速率与反应 动力学的初步概念 rimary Concertiet Chemical Rolo ,tnd action 1 inetics
第3章 化学反应速率与反应 动力学的初步概念 Chapter 3 Primary Conception of Chemical Reaction Rate and Reaction Kinetics

随着空气中的二氧化硫的浓度的增加使得酸雨的 浓度也在增加.结果,文物被腐蚀的速度也在加快 上页下页节首节尾
2 随着空气中的二氧化硫的浓度的增加使得酸雨的 浓度也在增加.结果,文物被腐蚀的速度也在加快

3.1化学反应速率的表示方法 expression method of chemical reaction rate 3.2反应速率理论简介 briefly introductory to reaction rate theory 33影响化学反应速率的因素 influential factors on chemical reaction rate 3,4化学反应机理的某些概念 concepts relevance to chemical reaction mechanism 章首 结束
3.1 化学反应速率的表示方法 3.3 影响化学反应速率的因素 3.2 反应速率理论简介 3.4 化学反应机理的某些概念 expression method of chemical reaction rate influential factors on chemical reaction rate briefly introductory to reaction rate theory concepts relevance to chemical reaction mechanism
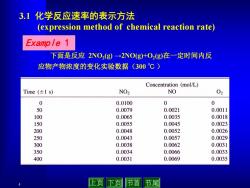
3.1化学反应速率的表示方法 (expression method of chemical reaction rate) Example 1 下面是反应2NO2g)→2NOg)+O2(g)在一定时间内反 应物产物浓度的变化实验数据(300℃) Concentration (mol/L) Time(±1s) NO2 NO 02 0 0.0100 0 0 50 0.0079 0.0021 0.0011 100 0.0065 0.0035 0.0018 150 0.0055 0.0045 0.0023 200 0.0048 0.0052 0.0026 250 0.0043 0.0057 0.0029 300 0.0038 0.0062 0.0031 350 0.0034 0.0066 0.0033 400 0.0031 0.0069 0.0035 止页 下页 节首 节尾
4 3.1 化学反应速率的表示方法 (expression method of chemical reaction rate) 下面是反应 2NO2(g) →2NO(g)+O2(g)在一定时间内反 应物产物浓度的变化实验数据(300 ℃ ) Example 1
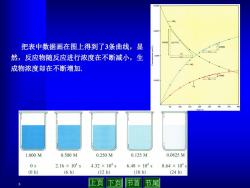
0.010 0.0073 把表中数据画在图上得到了3条曲线,显 然,反应物随反应进行浓度在不断减小,生 10 成物浓度却在不断增加 1.000M 0.500M 0.250M 0.125M 0.0625M 0s 2.16×104s 4.32×104s 6.48×104s 8.64×104s (0h) (6h) (12h) (18h) (24h) 止页下页 节首 节尾
5 把表中数据画在图上得到了3条曲线,显 然,反应物随反应进行浓度在不断减小,生 成物浓度却在不断增加
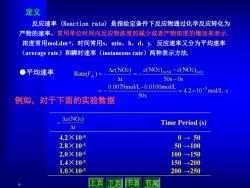
定义 反应速率 (Reaction rate))是指给定条件下反应物通过化学反应转化为 产物的速率,常用单位时间内反应物浓度的减少或者产物浓度的增加来表示, 浓度常用mol.dm3,时间常用s,min,h,d,y.反应速率又分为平均速率 (average rate)和瞬时速率(instaneous rate)两种表示方法, ●平均速率 Rate(VA)=- △cNO2 c(NO2)=50-c(NO2)=0 △t 50s-0s 0.0079molL-0.0100molL=42×10-5molL-s 50s 例如,对于下面的实验数据 △c(NO) Time Period (s) △7 4.2×105 0→50 2.8×10-5 50→100 2.0×105 100→150 1.4×10-s 150→200 1.0×10-5 200→250 上页下页 节首 节尾
6 反应速率 (Reaction rate) 是指给定条件下反应物通过化学反应转化为 产物的速率,常用单位时间内反应物浓度的减少或者产物浓度的增加来表示. 浓度常用mol.dm-3,时间常用s,min,h,d,y. 反应速率又分为平均速率 (average rate)和瞬时速率(instaneous rate)两种表示方法. 定义 4.2 10 mol/L s 50s 0.0079mol/L- 0.0100mol/L 50s 0s (NO ) (NO ) (NO ) Rate( ) 5 0 2 50 2 2 A t t c c t c V t c (NO2) Time Period (s) 4.2×10-5 2.8×10-5 2.0×10-5 1.4×10-5 1.0×10-5 0 → 50 50 →100 100 →150 150 →200 200 →250 ●平均速率 例如,对于下面的实验数据

Example 2 用反应物和产物表示都可以 Rate of consumption Rate of production 2(Rate of production of NO2 ofNO of02) △c(NO2) △cNO) At △t △ 对于一般的化学反应: aA +bB +Y 3Z dCA dcB dcy dcz adt bdt ydt zdt ▲实际工作中如何选择,往往取决于哪一种物质更易通过试验 监测其浓度变化 ▲速率方程相同,但各自的不同. 止页下页 节首节尾
7 Rate of consumption of NO2 Rate of production of NO 2(Rate of production of O2 = = ) t c (NO2) t c (NO) t c(O ) 2 2 = = z t c y t c b t c a t c d d d d d d d d A B Y Z aA + bB yY + zZ ▲实际工作中如何选择,往往取决于哪一种物质更易通过试验 监测其浓度变化. ▲速率方程相同,但各自的k不同. 对于一般的化学反应: 用反应物和产物表示都可以 Example 2

u® 反应2W+X一Y+Z哪种速率表达式是正确的? dc() dc(Y) dt dt b de(X) dc(W) dt dt dc(Z) dc(Y) c dt dt dc(W) d. dc(Z) dt dt 上页下页节首 节尾
8 Question 1 反应 2W+X Y+Z 哪种速率表达式是正确的? t c W t c Z t c Y t c Z t c W t c X t c Y t c X d d ( ) d d ( ) d d ( ) d d ( ) d d ( ) d d ( ) d d ( ) d d ( ) d. c. b. a.
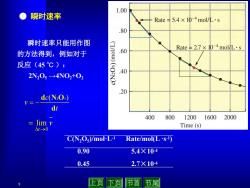
1.00 瞬时速率 Rate5.4×10-4mol/L·s .80 瞬时速率只能用作图 的方法得到,例如对于 11110 Rate¥2.7×10-4mol/L·s .60 反应(45℃): (SOZN) .40 2N205→4N02+02 .20 dc(N2O;) =- di 400 800 12001600 2000 lim v Time (s) △1-→0 C(N2Os)/mol-L-1 Rate/mol(Ls-1) 0.90 5.4X10- 0.45 2.7×104 9 上页 下页 节首节尾
9 v t 0 lim ● 瞬时速率 t c v d d (N2O5) C(N2O5)/mol·L-1 Rate/mol(L ·s -1) 0.90 5.4×10-4 0.45 2.7×10-4 瞬时速率只能用作图 的方法得到,例如对于 反应(45 ℃ ): 2N2O5 →4NO2+O2

3.2反应速率理论简介 (briefly introductory to reaction rate theory) 化学反应的发生总是伴随电子的转移或重新分配,这种转移 或重新分配似乎只有通过相关原子的接触才可能实现。 (1)碰撞理论 1918年lewis以气体分子运动论为基础提出. 对于反应 O3(g)+NO(g)→NO2(g)+O2(g〉 v=kc(NO)c(O3) 发生有效碰撞的两个基本前提: 。碰撞粒子的动能必须足够大 ●对有些物种而言,碰撞的几何方位要适当 10 止页下页节首节尾
10 3.2 反应速率理论简介 (briefly introductory to reaction rate theory) 1918年 lewis 以气体分子运动论为基础提出. 发生有效碰撞的两个基本前提: ● 碰撞粒子的动能必须足够大 ● 对有些物种而言,碰撞的几何方位要适当 O (g) NO(g) NO (g) O (g) 3 2 2 (NO) (O ) 3 kc c 对于反应 (1)碰撞理论 化学反应的发生总是伴随电子的转移或重新分配,这种转移 或重新分配似乎只有通过相关原子的接触才可能实现
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西北大学:《普通化学》课程教学资源(PPT课件)第二章 化学键与化学结构 Chemical Bond And Molecular Structure.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十二章 稀土元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十一章 过渡金属(Ⅱ)§21.1 铁系元素 §21.2 铂系元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十章 过渡金属(I)§20.1 概述 §20.2 Ti副族 §20.3 钒副族 §20.4 铬副族 §20.5 锰副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十八章 铜、锌副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十七章 碱金属和碱土金属.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十六章 硼族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十五章 碳族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十四章 氮族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十三章 氧族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十二章 卤素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十一章 氧化还原反应.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十章 电解质溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第九章 配位平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第八章 化学平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第七章 缓冲溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第六章 化学热力学初步.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第五章 电化学与金属腐蚀.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第四章 化学键与分子结构(离子键理论).ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第三章 原子结构(原子核外电子运动状态).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第四章 化学热力学的初步概念与化学平衡 Primary Conception of Chemical Thermodynamics & Chemical Equilibrium.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第六章 电解质溶液和非电解质溶液 Electrolyte Solution and Non Electrolyte Solution.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第七章 氧化还原反应 Oxidation-reduction reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第八章 配位化合物 Coordination Compounds.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十章 p区元素 p-block elements(一).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十一章 p区元素 p Block Elements(二).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十二章 d区元素 d-Blocks Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十三章 f区元素 f-Block Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)绪论 Inorganic Chemistry(主讲:刘洪).ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二章 分子结构 Molecular Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第三章 晶体结构 Crystal Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第四章 配位化合物 Coordination Compounds.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第五章 化学热力学基础 Primary Conception of Chemical Thermodynamics.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第六章 化学平衡常数 Equilibrium constant.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十一章 电化学基础 The basic of electronic-chemistry.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十二章 配位平衡 Coordination Equilibrium.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十四章 卤素 Halogen.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十五章 氧族元素 Oxygen family element.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十六章 氮磷砷 Nitrogen, Phosphorus and Arsenic.ppt
