西昌学院:《无机化学》课程教学资源(PPT课件)第六章 化学平衡常数 Equilibrium constant

第6章 化学平衡常数 Chapter 6 Equilibrium constant
第6章 化学平衡常数 Chapter 6 Equilibrium constant

本章要求 1、建立化学平衡常数的概念。 2、掌握反应产率或反应物转化为产物的转化率的计算。 3、学会讨论浓度、分压、总压和温度对化学平衡的影响。 内容提要 ●化学平衡状态 。平衡常数 。浓度对化学平衡的影响 压力对化学平衡的影响 温度对化学平衡的影响 上页下页 节首节尾
2 本章要求 1、建立化学平衡常数的概念。 2、掌握反应产率或反应物转化为产物的转化率的计算。 3、学会讨论浓度、分压、总压和温度对化学平衡的影响。 ● 化学平衡状态 ● 平衡常数 ● 浓度对化学平衡的影响 ● 压力对化学平衡的影响 ● 温度对化学平衡的影响 内容提要
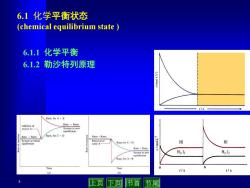
6.1化学平衡状态 (chemical equilibrium state 6.1.1化学平衡 6.1.2勒沙特列原理 Rate:for A.B Rate;=Rate? System at new equiibnum Rate Rate? Rate:for C D Rater=Rate? Rate:for C+D I-Tlow/ H H System at new Hz,l H2,l Rater for A.H Time Time b t/s t/s 上页 下页 节首节尾
3 6.1 化学平衡状态 (chemical equilibrium state ) 6.1.1 化学平衡 6.1.2 勒沙特列原理

6.1.1化学平衡 平衡状态(equilibrium state) 什么是平衡状态? 就是△G=0或者u正=u负 化学反应有可逆反应与不可逆反应之分,但大多数化学反应都 是可逆的.例如: H2(g)+I2(g)=2HⅡ(g 在密闭容器中,可逆反应不能进行到底。个别反应几乎能进行 到底.例如: MnO, 2KC103(S) △ 2KCI(S)+302(g) 化学平衡有以下几个鲜明的特点 ●客观上,系统的组成不再随时间而变 平衡是自发的 化学平衡是动态平衡 平衡组成与达到平衡的途径无关 上页 下页 节首 节尾
4 就是 DG = 0 或者 u正 = u负 6.1.1 化学平衡 平衡状态 (equilibrium state) 什么是平衡状态? 在密闭容器中,可逆反应不能进行到底. 个别反应几乎能进行 到底. 例如: MnO2 H (g) I (g) 2HI(g) 2 + 2 化学反应有可逆反应与不可逆反应之分,但大多数化学反应都 是可逆的. 例如: 2KClO3 (s) 2KCl (s) +3O2 (g) ● 客观上,系统的组成不再随时间而变 ● 平衡是自发的 ● 化学平衡是动态平衡 ● 平衡组成与达到平衡的途径无关 化学平衡有以下几个鲜明的特点

旧的平衡破坏了,又会建立起新的平衡, Rate:for A B Addition of Rater =Rate2 excess A- System at new equilibrium Rater=Rate2 Rate2 for C+D Rater Rate2 System at initial Removal of equilibrium some A- Ratez for C+D Rater Rate2 System at new equilibrium Ratei for A+B Time Time (a) (b) 上页下页节首 节尾
5 旧的平衡破坏了,又会建立起新的平衡

6.1.2勒沙特列(Le Chatelier)原理 l848年,法国科学家Le Chatelier提出: 如果改变维持化学平衡的条件(浓度、 压力和温度),平衡就会向着减弱这种改 变的方向移动. Le Chatelier)原理适用于处于平衡状 态的体系,也适用于相平衡体系。 勒沙特列 (Le Chatelier H,1850-1936) 法国无机化学家 巴黎大学教授 6 上页下页 节首 节尾
6 如果改变维持化学平衡的条件(浓度、 压力和温度),平衡就会向着减弱这种改 变的方向移动. Le Chatelier原理适用于处于平衡状 态的体系,也适用于相平衡体系. 1848年,法国科学家Le Chatelier 提出: 6.1.2 勒沙特列(Le Chatelier )原理 勒沙特列 (Le Chatelier H,1850-1936) 法国无机化学家 巴黎大学教授

注意:正确使用勒沙特列(Le Chatelier)原理 1、并不是改变任何条件,化学平衡都会 移动,而只有改变维持平衡的条件,平衡 才会移动。 2、勒沙特列原理指明的只是平衡移动的 方向。 3、Le Chatelier原理只是说的是热力学的 自发趋势,是一种可能性。 4、勒沙特列原理不能首先判断体系是否 处于平衡状态,不能进行定量。 上页下页节首节尾
7 2、勒沙特列原理指明的只是平衡移动的 方向。 3、Le Chatelier原理只是说的是热力学的 自发趋势,是一种可能性。 4、勒沙特列原理不能首先判断体系是否 处于平衡状态,不能进行定量。 1、并不是改变任何条件,化学平衡都会 移动,而只有改变维持平衡的条件,平衡 才会移动。 注意:正确使用勒沙特列(Le Chatelier )原理

6.2平衡常数(equilibrium constant) 6.2.1标准平衡常数(standard equilibrium constant) 由范特霍夫等温方程(p220): △rGm(T)=△,G(T)+RTnJ ●当反应达到平衡状态时 △Ga(TD+RT=0,令J平衡=k9 △,G(T=-RTnk9 在一定温度(T)时,上式中的△,G(T)、R和T都是定值, 即K9是一个常数,称为标准平衡常数。 ●标准平衡常数的意义: 在一定温度下,当气相系统达到化学平衡时,参与反应的各气体的 分压与热力学标压之比以方程式中的计量系数为幂的连乘积是一个 常数。. 上页 下页 节首 节尾
8 6.2 平衡常数 (equilibrium constant) 6.2.1 标准平衡常数(standard equilibrium constant) 由范特霍夫等温方程(p220): 即 是一个常数 称为标准平衡常数。 在一定温度 时,上式中的 、 和 都是定值, , ( ) ( ) K T Dr Gm T R T ● 当反应达到平衡状态时 ● 标准平衡常数的意义: 在一定温度下,当气相系统达到化学平衡时,参与反应的各气体的 分压与热力学标压之比以方程式中的计量系数为幂的连乘积是一个 常数。. rG G (T) RTlnJ D m = Dr m + (T) G (T) RTlnk G (T) RTlnJ 0 r m r m D = − D + = ,令J 平衡 = k

。对于气相反应 H2(g)+I,(g)=2HI(g) [p(HI)/p'P [p(H)1p[p2)/p] ●对于溶液中的反应 Sn2+(ag)+2Fe3+(ag)Sn4+(aq)+2Fe2+(aq) Ko= 上页下页节首节尾
9 H (g) I (g) 2HI(g) 2 + 2 [ (H )/ ][ (I )/ ] [ (HI)/ ] θ 2 θ 2 2 θ θ p p p p p p K = ( ) ( ) ( ) ( ) 2 2 θ 3 θ 2 4 θ 2 θ θ Sn Fe Sn Fe c /c c /c c /c c /c K + + + + = ● 对于气相反应 ● 对于溶液中的反应 Sn2+(aq)+2Fe3+(aq) Sn4+ (aq)+2Fe2+(aq)

●对于一般化学反应 aA(g)+bB(aq)+cC(s) xX(g)+yY(aq)+zZ① -poe"Hc(ep pA)yp°fcB)/c] ▲是无量纲的量; ▲是温度的函数,与浓度、分压无关; ▲标准平衡常数表达式必须与化学反应计量式相对应; ▲p是标态压力,p是各气体的分压; ▲C是标态浓度,C是溶液中各物质浓度; ▲纯物质不写在平衡常数表达式中! o 上页 下页 节首 节尾
10 ● 对于一般化学反应 ( ) ( ) ( ) ( ) b / / / / θ θ θ θ θ A B X Y aA(g) bB(aq) cC(s) xX(g) yY(aq) zZ(l) p p C C p p C C K a y x = + + + + ▲ Kq 是无量纲的量; ▲ Kq 是温度的函数,与浓度、分压无关; ▲标准平衡常数表达式必须与化学反应计量式相对应; ▲p θ是标态压力,p是各气体的分压; ▲C θ是标态浓度,C是溶液中各物质浓度; ▲纯物质不写在平衡常数表达式中!
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西昌学院:《无机化学》课程教学资源(PPT课件)第五章 化学热力学基础 Primary Conception of Chemical Thermodynamics.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第四章 配位化合物 Coordination Compounds.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第三章 晶体结构 Crystal Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二章 分子结构 Molecular Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)绪论 Inorganic Chemistry(主讲:刘洪).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十三章 f区元素 f-Block Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十二章 d区元素 d-Blocks Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十一章 p区元素 p Block Elements(二).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十章 p区元素 p-block elements(一).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第八章 配位化合物 Coordination Compounds.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第七章 氧化还原反应 Oxidation-reduction reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第六章 电解质溶液和非电解质溶液 Electrolyte Solution and Non Electrolyte Solution.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第四章 化学热力学的初步概念与化学平衡 Primary Conception of Chemical Thermodynamics & Chemical Equilibrium.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第三章 化学反应速率与反应动力学的初步概念 Primary Conception of Chemical Reaction Rate and Reaction Kinetics.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第二章 化学键与化学结构 Chemical Bond And Molecular Structure.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十二章 稀土元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十一章 过渡金属(Ⅱ)§21.1 铁系元素 §21.2 铂系元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十章 过渡金属(I)§20.1 概述 §20.2 Ti副族 §20.3 钒副族 §20.4 铬副族 §20.5 锰副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十八章 铜、锌副族.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十一章 电化学基础 The basic of electronic-chemistry.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十二章 配位平衡 Coordination Equilibrium.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十四章 卤素 Halogen.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十五章 氧族元素 Oxygen family element.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十六章 氮磷砷 Nitrogen, Phosphorus and Arsenic.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十八章 非金属元素小结.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十九章 金属通论.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二十章 s区元素 s-Block Elements.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)分析化学绪论(授课人:丁杰).ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第一章 化学反应一般原理.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第二章 酸碱反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第三章 氧化还原反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第四章 原子结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第五章 分子结构和晶体结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第六章 配位化合物.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第七章 S区元素.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第八章 d区、ds区元素.ppt
- 《无机化学》课程教学资源(参考资料)ds区表格(铜、银、锌、镉、汞)重要化合物.doc
- 北京大学:《无机化学》课程教学课件(PPT讲稿)无机化学课程前言.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第一章 酸碱化学.ppt
