西昌学院:《无机化学》课程教学资源(PPT课件)第十八章 非金属元素小结

Chapter18非金属元素小结 18.1非金属单质的结构和性质 18.2分子型氢化物 18.3含氧酸 18.4非金属含氧酸盐的某些性质 18.5P区元素的次级周期性
Chapter 18 非金属元素小结 18.1 非金属单质的结构和性质 18.2 分子型氢化物 18.3 含氧酸 18.4 非金属含氧酸盐的某些性质 18.5 P区元素的次级周期性

18.1非金属单质的结构和性质 非金属占22种(金属约为90种)。无机物大都同非金属 有关,如酸和盐。无机酸分为无氧酸和含氧酸,即一些 非金属元素的氢化物及非金属氧化物的水合物。 在周期表的右侧,斜线将所有化学元素分为 金属和非金属两个部分。将元素分为这两大 类的主要根据是元素的单质的性质。 IIB IV8 VB 7 IA 准金属 非金属 0 He IIIA IVA VA VIAVIIA 809F o Ne 硼 碳 氧 氟 氖 137A 4 Si 15P 16S 17C118Ar 铝 硅 磷 硫 氯 氩 斜线附近的元素如B、Si、Ge、As、Sb、Se、 31 Ga 32 Ge 33 As 34 Se 35 Br Tc和Po等为准金属,它们既有金属的性质又有 镓 锗 砷 漠 氪 49 Ir 50S7 52 Te53 T 54Xe 非金属的性质。 锡 锑 碲 碘 氙 如果不算准金属B、Si、As、Se、Te),则 81T1 82 Pb 83B1 84 Po 85At 86 Rn 非金属只有17种所以在金属与非金属之间没有 铊 铅 铋 砹 截然的界线。 114 116 118 金属
18.1 非金属单质的结构和性质 非金属占22种(金属约为90种)。无机物大都同非金属 有关,如酸和盐。无机酸分为无氧酸和含氧酸,即一些 非金属元素的氢化物及非金属氧化物的水合物。 斜线附近的元素如B、Si、Ge、As、Sb、Se、 Te和Po等为准金属,它们既有金属的性质又有 非金属的性质。 如果不算准金属(B、Si、As、Se、Te),则 非金属只有17种所以在金属与非金属之间没有 截然的界线。 114 116 118 1 2 3 4 5 6 7 钅卢 钅杜 钅喜 钅波 钅黑 钅麦 镧系 锕系 钫 镭 铌 钽 银 金 镉 汞 铟 铊 锡 铅 锑 铋 碲 钋 砹 氡 碘 氙 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 锕 钍 镤 铀 镎 钚 镅 锔 锫 锎 锿 镄 钔 锘 铹 铷 铯 锶 钡 钇 锆 铪 钼 钨 锝 铼 钌 铑 钯 锇 铱 铂 氢 锂 氦 铍 硼 碳 氮 氧 氟 氖 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙 钪 钛 钒 铬 锰 铁 钴 镍 铜 锌 镓 锗 砷 硒 溴 氪 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn IB IA IIA IIIA IVA VA VIA VIIA IIIB IVB VB VIB VIIB VIII IIB Rf Db Sg Bh H s Mt Ac-Lr Uun Uuu Uub La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Cs Fr Sr Ba Ra Y La-Lu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 57 89-103 -71 1 2 3 4 5 6 7 氢 IA 1 H 114 116 118 铟 铊 锡 铅 锑 铋 碲 钋 砹 氡 碘 氙 氦 硼 碳 氮 氧 氟 氖 铝 硅 磷 硫 氯 氩 镓 锗 砷 硒 溴 氪 In Sn Sb Te I Xe Tl Pb Bi Po At Rn IIIA IVA VA VIA VIIA He B C N O F Ne Al Si P S Cl Ar Ga Ge As Se Br Kr 2 5 6 7 8 9 10 13 14 15 16 17 18 31 32 33 34 35 36 49 50 51 52 53 54 81 82 83 84 85 86 准金属 非金属 金属 在周期表的右侧,斜线将所有化学元素分为 金属和非金属两个部分。将元素分为这两大 类的主要根据是元素的单质的性质

18.1.1非金属单质的结构和物理性质 自学要求: 1、了解非金属单质中的共价键数为8-N(H2为2-N)。 2、第2周期中的0、N为什么易形成多重键?第3、4 周期的S、Se、P、As等则易形成单键? 3、非金属单质按其结构和性质大致可分为哪三类? 4、掌握单质C2、S、P、S和B与NaOH反应的方程
18.1.1 非金属单质的结构和物理性质 自学要求: 1、了解非金属单质中的共价键数为8-N(H2为2-N)。 2、第2周期中的O、N为什么易形成多重键?第3、4 周期的S、Se、P、As等则易形成单键? 3、非金属单质按其结构和性质大致可分为哪三类? 4、掌握单质Cl2、S、P、Si和B与NaOH反应的方程 式

18.1.2非金属单质的化学反应 1、活泼的非金属(F2、Cl2、Br2、O2、P、S)与金属元素形成 卤化物、氧化物、硫化物、氢化物或含氧酸盐等; 2、非金属元素彼此之间也能形成卤化物、氧化物、无氧酸、含氧酸 等; 3、大部分非金属单质不与水反应,卤素仅部分地与水反应,碳在赤 热条件下才与水蒸气反应: 4、非金属一般不与非氧化性稀酸反应,硼、碳、磷、硫、碘、砷等 被浓HNO3、浓H2SO4及王水氧化,硅在含氧酸中被钝化,只 能在有氧化剂存在的条件下与氢氟酸反应。 5、除碳、氮、氧外,非金属单质可和碱溶液反应,对于有变价的非 金属元素主要发生歧化反应: CL,+2NaOH ==NaClO NaCI+H,O 31,+6NaOH ===5NaI+NalO +3H,O 4P+3NaOH+3H,O===3NaH,PO,+PH 硅、硼则从碱中置换出氢气: Si+2NaOH+H2O===Na2SiO3 2H21 3B+2NaOH+2H20===NaBO2+3H,1
18.1.2 非金属单质的化学反应 1、 活泼的非金属(F2 、Cl2 、Br2 、O2 、P、S)与金属元素形成 卤化物、氧化物、硫化物、氢化物或含氧酸盐等; 2、非金属元素彼此之间也能形成卤化物、氧化物、无氧酸、含氧酸 等; 3、大部分非金属单质不与水反应,卤素仅部分地与水反应,碳在赤 热条件下才与水蒸气反应; 4、非金属一般不与非氧化性稀酸反应,硼、碳、磷、硫、碘、砷等 被浓HNO3 、浓H2SO4 及王水氧化,硅在含氧酸中被钝化,只 能在有氧化剂存在的条件下与氢氟酸反应。 5、除碳、氮、氧外,非金属单质可和碱溶液反应,对于有变价的非 金属元素主要发生歧化反应: 硅、硼则从碱中置换出氢气: Cl2 + 2NaOH ===NaClO + NaCl + H2O 3I2 + 6NaOH ===5NaI + NaIO3 + 3H2O 4P + 3NaOH + 3H2O ===3NaH2PO2 + PH3 Si + 2NaOH + H2O===Na2SiO3 + 2H2 ↑ 3B + 2NaOH + 2H2O ===NaBO2 + 3H2 ↑
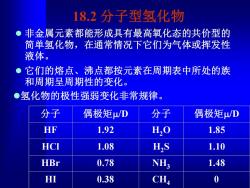
18.2分子型氢化物 非金属元素都能形成具有最高氧化态的共价型的 简单氢化物,在通常情况下它们为气体或挥发性 液体。 它们的熔点、沸点都按元素在周期表中所处的族 和周期呈周期性的变化。 ●氢化物的极性强弱变化非常规律。 分子 偶极矩μ/D 分子 偶极矩μ/D HF 1.92 H20 1.85 HCI 1.08 HS 1.10 HBr 0.78 NH; 1.48 HI 0.38 CH 0
18.2 分子型氢化物 ⚫ 非金属元素都能形成具有最高氧化态的共价型的 简单氢化物,在通常情况下它们为气体或挥发性 液体。 ⚫ 它们的熔点、沸点都按元素在周期表中所处的族 和周期呈周期性的变化。 分子 偶极矩m/D 分子 偶极矩m/D HF 1.92 H2O 1.85 HCl 1.08 H2S 1.10 HBr 0.78 NH3 1.48 HI 0.38 CH4 0 ⚫氢化物的极性强弱变化非常规律
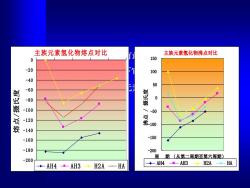
主族元素氢化物熔点对比 主族元素氢化物沸点对比 0 150 -20 100 40 50 60 -80 0 燕 -100 -50 -120 100 姿 -140 -160 -150 -180 -200 周期(丛第二周期至第六周期) -200 ◆AH4-AH3·-H2A-HA ◆AH4-AH3◆-H2A*-HA
⚫ 非金属元素都能形成具有最高氧化态的共价型的简 单氢化物,在通常情况下它们为气体或挥发性液体。 ⚫ 它们的熔点、沸点都按元素在周期表中所处的族和 周期呈周期性的变化。 主族元素氢化物熔点对比 -200 -180 -160 -140 -120 -100 -80 -60 -40 -20 0 熔点/摄氏度 AH4 AH3 H2A H A 主族元素氢化物沸点对比 -200 -150 -100 -50 0 50 100 150 周 期 (从第二周期至第六周期) 沸点 / 摄氏度 AH4 AH3 H2A HA

18.2.1热稳定性 ·分子型氢化物的热稳定性,在同一周期中,从 左到右逐渐增强; ●在同一族中,自上而下逐渐减小; ●变化规律与非金属元素电负性的变化规律是一 致的。在同一族中,分子型氢化物的热稳定性 还与键能自上而下越来越弱有关
18.2.1 热稳定性 ⚫ 分子型氢化物的热稳定性,在同一周期中,从 左到右逐渐增强; ⚫ 在同一族中,自上而下逐渐减小; ⚫ 变化规律与非金属元素电负性的变化规律是一 致的。在同一族中,分子型氢化物的热稳定性 还与键能自上而下越来越弱有关
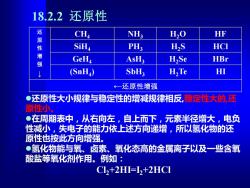
18.2.2还原性 还 CH, NH; H,O HF 性 SiHa PH; H,S HCI 强 GeHa AsH3 HSe HBr (SnH) SbH3 H,Te HI ←一还原性增强 ●还原性大小规律与稳定性的增减规律相反,稳定性大的,还 原性小。 ●在周期表中,从右向左,自上而下,元素半径增大,电负 性减小,失电子的能力依上述方向递增,所以氢化物的还 原性也按此方向增强。 ●氢化物能与氧、卤素、氧化态高的金属离子以及一些含氧 酸盐等氧化剂作用。例如: Cl2+2H=12+2HC1
18.2.2 还原性 还 原 性 增 强 ↓ CH4 NH3 H2O HF SiH4 PH3 H2S HCl GeH4 AsH3 H2Se HBr (SnH4 ) SbH3 H2Te HI ←还原性增强 ⚫还原性大小规律与稳定性的增减规律相反,稳定性大的,还 原性小。 ⚫在周期表中,从右向左,自上而下,元素半径增大,电负 性减小,失电子的能力依上述方向递增,所以氢化物的还 原性也按此方向增强。 ⚫氢化物能与氧、卤素、氧化态高的金属离子以及一些含氧 酸盐等氧化剂作用。例如: Cl2+2HI=I2+2HCl

18.2.3水溶液酸碱性和无氧酸的强度 。无氧酸的强度取决于下列平衡: HA+H2OH3O++A 常用K或DK的大小来衡量其酸碱性。 可以用△Ge=-2.303RTgK,来计算出K的值, 也可以用热力学循环来推算。 ●分子型氢化物中在水溶液中的pKa值(298K) CH~58 NH339 H,O 16 HF SiH~35 PHs 27 H>S 7 HCI 增强 GeHa 25 ASH3~19 HSe 4 HBr (SnH)~20 SbH3≈15 H,Te 3 HI -10 酸性增强→
18.2.3 水溶液酸碱性和无氧酸的强度 ⚫ 无氧酸的强度取决于下列平衡: HA+H2OH3O++A- 常用Ka或pKa的大小来衡量其酸碱性。 可以用rG=-2.303RTlgKa来计算出Ka的值, 也可以用热力学循环来推算。 ⚫ 分子型氢化物中在水溶液中的pKa值(298K) 酸 性 增 强 ↓ CH4 ~58 NH3 39 H2O 16 HF 3 SiH4 ~35 PH3 27 H2S 7 HCl –7 GeH4 25 AsH3 ~19 H2Se 4 HBr –9 (SnH4 )~20 SbH3 ~15 H2Te 3 HI -10 酸性增强→

18.3含氧酸 18.3.1最高氧化态氢氧化物的酸碱性 非金属元素氧化物的水合物为含有一个或多个OH基团的氢氧化 物。 第2、3周期非金属元素的氢氧化物 第2周期的元素 第3周期的元素 非金属元素R+n B+3 C4 N+5 Si4 p5 S+6 CI*7 R*/6H 0.15 0.11 0.08 0.30 0.25 0.210.19 配位数 3 2 2 4 4 3 3 是高氧化态的氢氧 B(OH)3 C(OH)4N(OH)5 Si(OH)4P(OH)s S(OH)CI(OH) 化物R(OHDn 脱水后的氢氧化物不脱水H2CO3HNO3 H2SiO3 H3PO4H2SO4 HCIO4 或不脱水
18.3.1最高氧化态氢氧化物的酸碱性 ⚫ 非金属元素氧化物的水合物为含有一个或多个OH基团的氢氧化 物。 ⚫ 这类化合物的中心原子R,它周围能结合多少个OH,取决于R+n的 电荷数及半径大小。 通常R+n的电荷高,半径大时,结合的OH基团数目多。当R+n 的电荷高且半径小时,例如Cl+7应能结合七个OH基团,但是由于 它的半径太小(0.027nm),容纳不了这许多OH,势必脱水,直 到Cl+7周围保留的异电荷离子或基团数目,既能满足Cl+7的氧化 态又能满足它的配位数。 ⚫ 处于同一周期的元素,其配位数大致相同。 非金属元素R 配位数 是高氧化态的氢氧 化 物 脱水后的氢氧化物 第2周期的元素 第3周期的元素 第2、3周期非金属元素的氢氧化物 不脱水 或不脱水 +n r / rO H - R n+ R(OH)n B +3 C +4 N +5 Si +4 P +5 S + 6 Cl +7 0.15 0.11 0.08 0.30 0.25 0.21 0.19 3 2 4 B(OH) 3 C(OH) 4 N(OH) 5 Si(OH) 4 S(OH) 6Cl(OH) P 7 (OH) 5 2 4 3 3 H2CO3 HNO3 H2 SiO3 H3 PO4H2 SO4 HClO4 18.3 含氧酸
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十六章 氮磷砷 Nitrogen, Phosphorus and Arsenic.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十五章 氧族元素 Oxygen family element.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十四章 卤素 Halogen.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十二章 配位平衡 Coordination Equilibrium.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十一章 电化学基础 The basic of electronic-chemistry.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第六章 化学平衡常数 Equilibrium constant.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第五章 化学热力学基础 Primary Conception of Chemical Thermodynamics.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第四章 配位化合物 Coordination Compounds.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第三章 晶体结构 Crystal Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二章 分子结构 Molecular Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)绪论 Inorganic Chemistry(主讲:刘洪).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十三章 f区元素 f-Block Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十二章 d区元素 d-Blocks Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十一章 p区元素 p Block Elements(二).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十章 p区元素 p-block elements(一).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第八章 配位化合物 Coordination Compounds.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第七章 氧化还原反应 Oxidation-reduction reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第六章 电解质溶液和非电解质溶液 Electrolyte Solution and Non Electrolyte Solution.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第四章 化学热力学的初步概念与化学平衡 Primary Conception of Chemical Thermodynamics & Chemical Equilibrium.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十九章 金属通论.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二十章 s区元素 s-Block Elements.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)分析化学绪论(授课人:丁杰).ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第一章 化学反应一般原理.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第二章 酸碱反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第三章 氧化还原反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第四章 原子结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第五章 分子结构和晶体结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第六章 配位化合物.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第七章 S区元素.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第八章 d区、ds区元素.ppt
- 《无机化学》课程教学资源(参考资料)ds区表格(铜、银、锌、镉、汞)重要化合物.doc
- 北京大学:《无机化学》课程教学课件(PPT讲稿)无机化学课程前言.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第一章 酸碱化学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第二章 配合物基础和配位立体化学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第三章 配位场理论和配合物的电子光谱.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第四章 配合物反应机理和动力学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第五章 非金属原子簇化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第六章 主族元素的有机金属化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第七章 金属羧基和π酸配体化合物.ppt
