西昌学院:《无机化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements

第1章 原子结构和 元素周期表 Chapter 1 Atomic Structure and Periodic Table of Elements 上页下页节首节尾
1 第 1 章 原子结构和 元素周期表 Chapter 1 Atomic Structure and Periodic Table of Elements

本章教学要求 1. 初步了解原子核外电子运动的近代概念、原子能级、波粒 二象性、原子轨道(波函数)和电子云概念 2. 了解四个量子数对核外电子运动状态的描述,掌握四个量 子数的物理意义、取值范围。 3.熟悉s、p、d原子轨道的形状和方向 4. 理解原子结构的近似能级图,掌握原子核外电子排布的一 般规则和s、p、d、f区元素的原子结构特点 5. 会从原子的电子层结构了解元素性质,熟悉原子半径、电 离能、电子亲合能和电负性的周期性变化 下页 节首 节尾
2 1. 初步了解原子核外电子运动的近代概念、原子能级、波粒 二象性、原子轨道(波函数)和电子云概念. 2. 了解四个量子数对核外电子运动状态的描述,掌握四个量 子数的物理意义、取值范围. 3. 熟悉 s、p、d 原子轨道的形状和方向. 4. 理解原子结构的近似能级图,掌握原子核外电子排布的一 般规则和 s、p、d、f 区元素的原子结构特点. 5. 会从原子的电子层结构了解元素性质,熟悉原子半径、电 离能、电子亲合能和电负性的周期性变化. 本章教学要求

本章教学内容 1.1 道尔顿原子论 Dalton atomic theory 1.2相对原子质量(原子量) relative atomic weight 1.3原子的起源和演化 the origin and evolvement of atom 1.4氢原子结构的量子力学模型 the quantum mechanical model of the structure of hydrogen atom- 一玻尔行星模型 Bohr'model 1.5核外电子运动的量子力学模型 the wave mechanical model of the structure of atom 1.6基态原子的核外电子排布 ground-state electron configuration 1.7元素周期表 the periodic table of elements 1.8 元素周期性 atomic periodic 上页下页 节首 节尾
3 1.1 道尔顿原子论 Dalton atomic theory 1.2 相对原子质量(原子量) relative atomic weight 1.4 氢原子结构的量子力学模型 the quantum mechanical model of the structure of hydrogen atom — — 玻尔行星模型 Bohr’ model 1.5 核外电子运动的量子力学模型 the wave mechanical model of the structure of atom 1.6 基态原子的核外电子排布 ground-state electron configuration 1.7 元素周期表 the periodic table of elements 1.8 元素周期性 atomic periodic 本章教学内容 1. 3 原子的起源和演化 the origin and evolvement of atom

1.1道尔顿原子论 原子结构理论的发展简史 古代希腊的原子理论 道尔顿(J.Dolton)的原子理论-19世纪初 卢瑟福E.Rutherford)的行星式原子模型-l9 世纪末 近代原子结构理论-氢原子光谱 上页下页 节首节尾
4 原子结构理论的发展简史 古代希腊的原子理论 道尔顿(J. Dolton) 的原子理论- 19世纪初 卢瑟福(E.Rutherford)的行星式原 子模型-19 世纪末 近代原子结构理论-氢原子光谱 1.1 道尔顿原子论

1.1.1古希腊原子论Democr itus(460-370B.C) 内容: 宇宙由虚空和原子构成: 每一种物质由一种原子构成; 原子是物质最小的、不可再分的、永存不变的 微粒。 上页下页节首节尾
5 1.1.1古希腊原子论 Democritus(460-370 B.C) 内容: 宇宙由虚空和原子构成; 每一种物质由一种原子构成; 原子是物质最小的、不可再分的、永存不变的 微粒

11.2化学原子论-道尔顿原子论 原子是化学上最重要、使用最频繁的术语之一,原是希腊语中意 为“不可再分”意思.随着科学的发展,道尔顿(Dalton J)于1805年 提出了第一个现代原子论,但他接受了“不可再分”的概念. 道尔顿原子论要点: 每一种化学元素有一种原子: 同种原子质量相同,不同种原子质量不同: 原子不可再分: 一种原子不会转变为另一种原子: 化学反应只是改变了原子的结合方式, 使反应前的物质变成反应后的物质。 道尔顿原子论的试验基础是对化学物质的定量测定。 18世纪中叶,一系列定量定律的发现: 1785年拉瓦锡(法国)-质量守恒定律; 1797年李希特()-当量定律; 道尔顿,J. 1799年普鲁斯特(法国)-定比定律; 1805年道尔顿(英国)-倍比定律 广贝 下页 节首 节尾
6 道尔顿原子论要点: 每一种化学元素有一种原子; 同种原子质量相同,不同种原子质量不同; 原子不可再分; 一种原子不会转变为另一种原子; 化学反应只是改变了原子的结合方式, 使反应前的物质变成反应后的物质。 1.1.2 化学原子论-道尔顿原子论 原子是化学上最重要、使用最频繁的术语之一, 原是希腊语中意 为“不可再分”意思. 随着科学的发展, 道尔顿(Dalton J)于1805年 提出了第一个现代原子论, 但他接受了“不可再分”的概念. 道尔顿原子论的试验基础是对化学物质的定量测定。 18世纪中叶,一系列定量定律的发现: 1785年 拉瓦锡(法国)-质量守恒定律; 1797年 李希特()-当量定律; 1799年 普鲁斯特(法国)-定比定律; 1805年 道尔顿(英国)-倍比定律

1.1.3道尔顿原子论的贡献 道尔顿提出了原子量的概念,并 氧 氢 氮 碳 用实验测定了一些元素的相对原子质 量。 道尔顿用符号来表示原子,是最 磷 硫 钾 钡 早的元素符号。图中他给出的许多 分子组成是错误的。这给人以历史 的教训—要揭示科学的真理不能 0000⊕0000 光凭想象,更不能遵循道尔顿提出 水一氧化氮二氧化硫 甲烷 的所谓“思维经济原则”,客观世界 的复杂性不会因为人类或某个人主 观意念的简单化而改变。 为贝采里乌斯原子量和元素符 号莫定了坚实的基础,极大地推动 了化学的发展。 氢氧化钾 碳酸钡 上页 下页 节首 节尾
7 1.1.3 道尔顿原子论的贡献 道尔顿用符号来表示原子,是最 早的元素符号。图中他给出的许多 分子组成是错误的。这给人以历史 的教训——要揭示科学的真理不能 光凭想象,更不能遵循道尔顿提出 的所谓“思维经济原则”,客观世界 的复杂性不会因为人类或某个人主 观意念的简单化而改变。 氧 氢 氮 碳 磷 硫 钾 钡 水 一氧化氮 二氧化硫 甲 烷 氢氧化钾 碳酸钡 道尔顿提出了原子量的概念,并 用实验测定了一些元素的相对原子质 量。 为贝采里乌斯原子量和元素符 号奠定了坚实的基础,极大地推动 了化学的发展
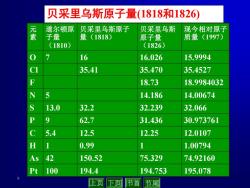
贝采里乌斯原子量(1818和1826) 道尔顿原 贝采里鸟斯原子 贝采里乌斯 现今相对原子 素 子量 量(1818) 原子量 质量(1997) (1810) (1826) 16 16.026 15.9994 35.41 35.470 35.4527 18.73 18.9984032 N 5 14.186 14.00674 13.0 32.2 32.239 32.066 9 62.7 31.436 30.973761 C 5.4 12.5 12.25 12.0107 H 0.99 1 1.00794 As 42 150.52 75.329 74.92160 力 100 194.4 194.753 195.078 上页 下页 节首节尾
8 贝采里乌斯原子量(1818和1826) 元 素 道尔顿原 子量 (1810) 贝采里乌斯原子 量(1818) 贝采里乌斯 原子量 (1826) 现今相对原子 质量(1997) O 7 16 16.026 15.9994 Cl 35.41 35.470 35.4527 F 18.73 18.9984032 N 5 14.186 14.00674 S 13.0 32.2 32.239 32.066 P 9 62.7 31.436 30.973761 C 5.4 12.5 12.25 12.0107 H 1 0.99 1 1.00794 As 42 150.52 75.329 74.92160 Pt 100 194.4 194.753 195.078

1.2相对原子质量(原子量) 1.2.1元素原子序数和元素符号 1.2.2核素、同位素和同位素丰度 1.2.3原子的质量 1.2.4元素的相对原子质量(原子量) 上页下页节首节尾
9 1.2 相对原子质量(原子量) 1.2.1 元素 原子序数和元素符号 1.2.2 核素、同位素和同位素丰度 1.2.3 原子的质量 1.2.4 元素的相对原子质量(原子量)

1.2.1元素、原子序数和元素符号 具有一定核电荷数(等于核内质子数) 的原 子称为一种(化学)元素。 按(化学)元素的核电荷数进行排序,所得 序号叫做原子序数。 每一种元素有一个用拉丁字母表达的元素符 号。在不同场合,元素符号可以代表一种元 素,或者该元素的一个原子,也可代表该元 素的1摩尔原子。 9 上页 下页 节首 节尾
10 1.2.1元素、原子序数和元素符号 具有一定核电荷数(等于核内质子数)的原 子称为一种(化学)元素。 按(化学)元素的核电荷数进行排序,所得 序号叫做原子序数。 每一种元素有一个用拉丁字母表达的元素符 号。在不同场合,元素符号可以代表一种元 素,或者该元素的一个原子,也可代表该元 素的1摩尔原子
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西昌学院:《无机化学》课程教学资源(PPT课件)绪论 Inorganic Chemistry(主讲:刘洪).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十三章 f区元素 f-Block Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十二章 d区元素 d-Blocks Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十一章 p区元素 p Block Elements(二).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十章 p区元素 p-block elements(一).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第八章 配位化合物 Coordination Compounds.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第七章 氧化还原反应 Oxidation-reduction reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第六章 电解质溶液和非电解质溶液 Electrolyte Solution and Non Electrolyte Solution.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第四章 化学热力学的初步概念与化学平衡 Primary Conception of Chemical Thermodynamics & Chemical Equilibrium.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第三章 化学反应速率与反应动力学的初步概念 Primary Conception of Chemical Reaction Rate and Reaction Kinetics.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第二章 化学键与化学结构 Chemical Bond And Molecular Structure.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十二章 稀土元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十一章 过渡金属(Ⅱ)§21.1 铁系元素 §21.2 铂系元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十章 过渡金属(I)§20.1 概述 §20.2 Ti副族 §20.3 钒副族 §20.4 铬副族 §20.5 锰副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十八章 铜、锌副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十七章 碱金属和碱土金属.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十六章 硼族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十五章 碳族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十四章 氮族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十三章 氧族元素.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二章 分子结构 Molecular Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第三章 晶体结构 Crystal Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第四章 配位化合物 Coordination Compounds.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第五章 化学热力学基础 Primary Conception of Chemical Thermodynamics.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第六章 化学平衡常数 Equilibrium constant.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十一章 电化学基础 The basic of electronic-chemistry.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十二章 配位平衡 Coordination Equilibrium.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十四章 卤素 Halogen.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十五章 氧族元素 Oxygen family element.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十六章 氮磷砷 Nitrogen, Phosphorus and Arsenic.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十八章 非金属元素小结.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十九章 金属通论.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二十章 s区元素 s-Block Elements.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)分析化学绪论(授课人:丁杰).ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第一章 化学反应一般原理.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第二章 酸碱反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第三章 氧化还原反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第四章 原子结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第五章 分子结构和晶体结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第六章 配位化合物.ppt
