西北大学:《普通化学》课程教学资源(PPT课件)第八章 配位化合物 Coordination Compounds

第8章 配位化合物 Chanter8 Coordination Comperndls
Chapter 8 Coordination Compounds 第 8 章 配位化合物

8.1相关的定义和命名 The relating definitions and nomenclature 8.2化学键理论 Chemical bond theory 8.3异构现象与立体化学 Isomerism and stereochemistry 8.4配合物的稳定性 Stability of the complex 8.5配合物的应用 Apllication of the complex 章首 结束
8.1 相关的定义和命名 8.2 化学键理论 8.3 异构现象与立体化学 8.4 配合物的稳定性 8.5 配合物的应用 The relating definitions and nomenclature Chemical bond theory Isomerism and stereochemistry Stability of the complex Apllication of the complex
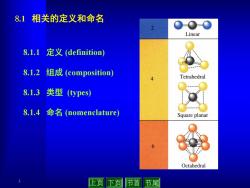
81相关的定义和命名 2 0-0-0 Linear 8.1.1定义(definition 8.1.2组成(composition) Tetrahedral 8.1.3类型(ypes) 8.1.4命名(nomenclature) Square planar Octahedral 上页下节首节尾
3 8.1.1 定义 (definition) 8.1.2 组成 (composition) 8.1.3 类型 (types) 8.1.4 命名 (nomenclature) 8.1 相关的定义和命名

8.1.1定义(definition) 配合物可看成是一类由简单化合物反应生成的复杂化合物: CuSO+4 NH3===Cu(NH3)SO 产物1) 3NaF +AIF3==Na3[AIF (产物2) SiF +2 HF==H2 SiF (产物3) Ni +4CO==Ni(CO)l (产物4) K2zS04+Al2(S04)3+24H20==2KA(S0,)212H0(产物5 显然,这些产物中: ●都存在一个“配位个体” ● “配位个体”相对稳定,既可存在于晶体中,也可存在于溶液 中 ●与“复盐(double salts)不同,但又无绝对的界线 上页下节首节尾
4 8.1.1 定义 (definition) CuSO4 + 4 NH3 === [Cu(NH3)4]SO4 (产物1) 3NaF + AlF3 === Na3[AlF6] (产物2) SiF4 + 2 HF === H2[SiF6] (产物3) Ni + 4 CO === [Ni(CO)4] (产物4) 配合物可看成是一类由简单化合物反应生成的复杂化合物: ● 都存在一个“配位个体”. ● “配位个体”相对稳定,既可存在于晶体中,也可存在于溶液 中. ● 与“复盐 (double salts) 不同,但又无绝对的界线. K2SO4 +Al2(SO4)3+24 H2O === 2 KAl(SO4)2·12H2O (产物5) 显然,这些产物中:

配位化学的奠基人一维尔纳 1983年供职于苏黎世大学的Verner A提出 了天才的见解,被后人称之为维尔纳学说 ● 大多数化学元素表现出两种类型的化合 价,即主价和副价 元素形成配合物时倾向于主价和副价都 能得到满足 元素的副价指向空间确定的方向 NH: CI 维尔纳(Verner,A,1866一1919) HN、 NH 、 瑞士无机化学家因创立配位化学而获得 HN NH 1913年诺贝尔化学奖 NH; CI 上页 页 节首 节尾
5 配位化学的奠基人——维尔纳 ● 大多数化学元素表现出两种类型的化合 价,即主价和副价 ● 元素形成配合物时倾向于主价和副价都 能得到满足 ● 元素的副价指向空间确定的方向 1983年供职于苏黎世大学的Werner A 提出 了天才的见解,被后人称之为维尔纳学说. 维尔纳 (Werner, A, 1866—1919) 瑞士无机化学家.因创立配位化学而获得 1913年诺贝尔化学奖 Co NH3 Cl Cl Cl NH3 NH3 NH3 H3N H3N

8.1.2组成(composition)) 配位单元:由一个简单阳离子或原子和一定数目的中性分子或阴 离子以配位键结合,按一定的组成和空间构型形成一 个复杂的离子或分子形成的离子称为配离子,形成的 分子称为配分子 配合物:由配离子与带有相反电荷的离子组成的电中性化合物 以及不带电荷的配分子本身。 配分子:Ni(CO)4, [CoCI3(NH3)3] 配离子:BF4, [Fe(CN).]4,【CoNH3)s(H2O)+,【CuNH3)4]月 配合物:配酸HBF4 配盐 Ka[Fe(CN)].[Co(NH3)s(H2O)C13 配碱 Cu(NH3)4KOH)2 止页下页 节首 节尾
6 配位单元:由一个简单阳离子或原子和一定数目的中性分子或阴 离子以配位键结合,按一定的组成和空间构型形成一 个复杂的离子或分子.形成的离子称为配离子,形成的 分子称为配分子. 配 合 物:由配离子与带有相反电荷的离子组成的电中性化合物 以及不带电荷的配分子本身. 8.1.2 组成 (composition) 3 4 2 4 6 3 5 2 3 4 2 3 4 3 3 5 2 4- 4 6 4 3 3 3 Cu(NH ) (OH) K Fe(CN) , Co(NH ) (H O) Cl HBF BF , Fe(CN) , Co(NH ) (H O) , Cu(NH ) Ni(CO) , CoCl (NH ) 配碱 配盐 配合物:配酸 配离子: 配分子:
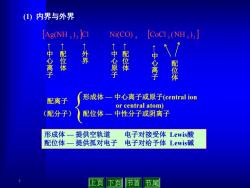
(1)内界与外界 Ag(NH),CI Ni(CO) [CoC1,(NH,)3] 中心离子 外界 忠 配位体 中心离子 配位体 配离子 形成体一中心离子或原子(central ion or central atom) (配分子〉 配位体一中性分子或阴离子 形成体一 提供空轨道 电子对接受体Lewis酸 配位体一 提供孤对电子 电子对给予体Lewis碱 上页 下页 节首 节尾
7 3 2 4 3 3 3 Ag(NH ) Cl Ni(CO) CoCl (NH ) ← 中 心 离 子 ← 中 心 离 子 ← 中 心 原 子 ← 配 位 体 ← 外 界 ← 配 位 体 配 位 体 形成体 — 中心离子或原子(central ion or central atom) 配位体 — 中性分子或阴离子 配离子 (配分子) 形成体 — 提供空轨道 电子对接受体 Lewis酸 配位体 — 提供孤对电子 电子对给予体 Lewis碱 (1) 内界与外界

(2)形成体 正离子(多) 中性原子(少) Fe(CO)s Ni(CO) 金属元素(多) 非金属元素(少》 BF 常见金属离子的配位数 1价金属离子 2价金属离子 3价金属离子 Cu时 2,4 Ca2+ 6 A3+ 4,6 Ag 2 Mg2+ 6 Cr3+ 6 Au时 2,4 Fe2+ 6 Fe3+ 6 C02+ 4,6 Co3+ 6 Cu2+ 4,6 Au3+ 4 Zn2+ 4,6 上页 下页 节首 节尾
8 正离子(多) 中性原子(少) Fe(CO)5 , Ni(CO)4 金属元素(多) 非金属元素(少) 2 4 S 6 BF iF (2) 形成体 常见金属离子的配位数 1价金属离子 2价金属离子 3价金属离子 Cu+ 2,4 Ca2+ 6 Al3+ 4,6 Ag+ 2 Mg2+ 6 Cr 3+ 6 Au+ 2,4 Fe 2+ 6 Fe 3+ 6 Co2+ 4,6 Co3+ 6 Cu2+ 4,6 Au3+ 4 Zn2+ 4,6

(3)配体和配位原子 负离子 X SCN-C,O CN 配位体 中性分子H,ONH3 en 配位原子:配位体中与中心离子(或原子)直接以配位键结合的原子 。单齿配体:一个配体中只含一个配位原子 XQH(羟基) CN-SCN(硫氰根) CO(羰基) NO(硝基)H2ONH3NCS(异硫氰根) ● 多齿配体:一个配体中含有多个配位原子 ●二齿配体:例如,乙二胺(en)H,N一CH,一CH,一NH, 乙二酸根(草酸根)C,O ●六齿配体:乙二胺四乙酸根EDTA(Y4-) [I 9 上页下节首节尾
9 配位体 H O NH CO en X SCN C O CN 2 3 2 2 4 中性分子 负离子 配位原子:配位体中与中心离子(或原子)直接以配位键结合的原子. ● 单齿配体: 一个配体中只含一个配位原子. N O H O N H N CS X O H C N SCN C O (2 硝基) 2 3 (异硫氰根) (羟基) (硫氰根) (羰基) (3) 配体和配位原子 ● 多齿配体: 一个配体中含有多个配位原子 ● 二齿配体:例如,乙二胺(en)H2 N CH2 CH2 NH2 乙二酸根(草酸根) 2 C2O4 O O C C O O • • • • 2– ● 六齿配体:乙二胺四乙酸根 EDTA(Y4-)

(4) 配位数及电荷 ●与中心离子(或原子)成键的配位原子的总数 配位数=∑配位体的数目×齿数 单齿配体 Cu(NH3)4+ 4 [PtCI3 (NH3)] 3+1=4 多齿配体 【coCl2(en2]P4 2+2x2=6 [AIC2O43]月 3×2=6 【Ca(EDTA 1×6=6 ●配离子与形成体的电荷数 (+2 Ag(S2O3)2 (+3) (+ Fe(CN)6 赤血盐, K Fe(CN)6 黄血盐 (+3) (0) Co Cl3(NH3)3 Fe(CO)s 10 止页下页 节首节尾
10 配位数 配位体 i的数目齿数 Ca(EDTA) 1 6 6 Al(C O ) 3 2 6 CoCl (en) 2 2 2 6 PtCl (NH ) 3 1 4 Cu(NH ) 4 2 3 2 4 3 2 2 2 3 3 4 3 多齿配体 单齿配体 ● 与中心离子(或原子)成键的配位原子的总数 (4) 配位数及电荷 ● 配离子与形成体的电荷数 5 (0) 3 3 3 ( 3) 6 ( 2) 6 4 ( 3) 3 3 3 ( 2) 3 2 3 2 ( ) Co Cl (NH ) , Fe(CO) K Fe (CN) , K Fe (CN) Ag(S O ) , Pt Cl (NH ) 赤血盐 黄血盐
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西北大学:《普通化学》课程教学资源(PPT课件)第七章 氧化还原反应 Oxidation-reduction reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第六章 电解质溶液和非电解质溶液 Electrolyte Solution and Non Electrolyte Solution.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第四章 化学热力学的初步概念与化学平衡 Primary Conception of Chemical Thermodynamics & Chemical Equilibrium.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第三章 化学反应速率与反应动力学的初步概念 Primary Conception of Chemical Reaction Rate and Reaction Kinetics.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第二章 化学键与化学结构 Chemical Bond And Molecular Structure.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十二章 稀土元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十一章 过渡金属(Ⅱ)§21.1 铁系元素 §21.2 铂系元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十章 过渡金属(I)§20.1 概述 §20.2 Ti副族 §20.3 钒副族 §20.4 铬副族 §20.5 锰副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十八章 铜、锌副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十七章 碱金属和碱土金属.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十六章 硼族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十五章 碳族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十四章 氮族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十三章 氧族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十二章 卤素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十一章 氧化还原反应.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十章 电解质溶液.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第九章 配位平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第八章 化学平衡.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第七章 缓冲溶液.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十章 p区元素 p-block elements(一).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十一章 p区元素 p Block Elements(二).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十二章 d区元素 d-Blocks Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十三章 f区元素 f-Block Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)绪论 Inorganic Chemistry(主讲:刘洪).ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二章 分子结构 Molecular Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第三章 晶体结构 Crystal Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第四章 配位化合物 Coordination Compounds.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第五章 化学热力学基础 Primary Conception of Chemical Thermodynamics.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第六章 化学平衡常数 Equilibrium constant.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十一章 电化学基础 The basic of electronic-chemistry.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十二章 配位平衡 Coordination Equilibrium.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十四章 卤素 Halogen.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十五章 氧族元素 Oxygen family element.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十六章 氮磷砷 Nitrogen, Phosphorus and Arsenic.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十八章 非金属元素小结.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十九章 金属通论.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二十章 s区元素 s-Block Elements.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)分析化学绪论(授课人:丁杰).ppt
