西北大学:《普通化学》课程教学资源(PPT课件)第十二章 d区元素 d-Blocks Elements

第十二章d区元素 Chapter 12 d-Blocks Elements
1 第十二章 d 区元素 Chapter 12 d-Blocks Elements
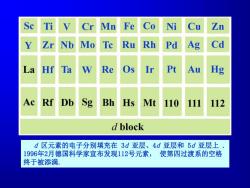
Mn Fe Co Ni Cu Zn 10 Ru Rh Pd Ag Cd La Hf Ta W Re Os Ir Pt Au Hg Ac Rf Db Sg Bh Hs Mt 110 111 112 d block d区元素的电子分别填充在3d亚层、4d亚层和5d亚层上 1996年2月德国科学家宣布发现112号元素,使第四过渡系的空格 终于被添满
2 d 区元素的电子分别填充在 3d 亚层、4d 亚层和 5d 亚层上 . 1996年2月德国科学家宣布发现112号元素, 使第四过渡系的空格 终于被添满

本章教学要求 1.了解d区元素的通性,即d电子化学的特征 2.掌握钛单质、TiO2、TiCL1的性质和制备,钛合金的应用; 3.掌握铬单质的特性与制备,三价铬与六价铬的转变; 4.了解钼和钨的简单化合物及同多酸、杂多酸的概念; 5.掌握从软锰矿制备单质锰,锰的变价及其氧化性: 6. 了解铁、钴、镍氧化还原性变化规律,掌握其氧化物和氢氧 化物性质; 7. 掌握铜单质及其常见化合物,着重了解其歧化反应; 8.了解锌、镉、汞的单质及重要化合物
3 本章教学要求 1.了解 d 区元素的通性,即 d 电子化学的特征; 3.掌握铬单质的特性与制备,三价铬与六价铬的转变; 4.了解钼和钨的简单化合物及同多酸、杂多酸的概念; 8.了解锌、镉、汞的单质及重要化合物. 7.掌握铜单质及其常见化合物,着重了解其歧化反应; 6.了解铁、钴、镍氧化还原性变化规律,掌握其氧化物和氢氧 化物性质; 5.掌握从软锰矿制备单质锰,锰的变价及其氧化性; 2.掌握钛单质、TiO2、TiCl4 的性质和制备,钛合金的应用;

12.1 通性Ageneral survey 3 钛 Titanium 本章内容 铬 Chromium 124 钼和钨Molybdnum and tungsten 125 锰 Manganese 12.6 铁、钴、镍Iron,cobalt and nickel 12.7 铜Copper 12.8 贵金属元素的不活泼性和催化性能 Non-active and catalysis properties for the noble elements 12.9 锌、镉、汞Zinc,cadmium and mercury 12.10过渡元素的金属有机化合物 Transitional metal-organic compounds 12.11过渡元素金属有机化学与均相催化 Transitional metal-organic chemistry and homogenous catalyst
4 12.1 通性 12.10 过渡元素的金属有机化合物 12.2 钛 12.3 铬 12.4 钼和钨 12.5 锰 12.6 铁、钴、镍 12.7 铜 12.8 贵金属元素的不活泼性和催化性能 12.9 锌、镉、汞 12.11 过渡元素金属有机化学与均相催化 Ageneral survey Titanium Chromium Molybdnum and tungsten Manganese Iron, cobalt and nickel Copper Non-active and catalysis properties for the noble elements Zinc, cadmium and mercury

12.1通性 (General survey) d区元素显示出许多区别于主族元素的性质: ●熔、沸点高,硬度、密度大的金属大都集中在这一区 ●不少元素形成有颜色的化合物 ●许多元素形成多种氧化态从而导致丰富的氧化还原行为 ●形成配合物的能力比较强,包括形成经典的维尔纳配合物 和金属有机配合物 ●参与工业催化过程和酶催化过程的能力强 d区元素所有这些特征不同程度上与价层d电子的 存在有关,因而有人将d区元素的化学归结为d电子 的化学
5 ● 熔、沸点高,硬度、密度大的金属大都集中在这一区 ● 不少元素形成有颜色的化合物 ● 许多元素形成多种氧化态从而导致丰富的氧化还原行为 ● 形成配合物的能力比较强,包括形成经典的维尔纳配合物 和金属有机配合物 ● 参与工业催化过程和酶催化过程的能力强 d 区元素显示出许多区别于主族元素的性质: 12.1 通性 (General survey) d 区元素所有这些特征不同程度上与价层 d 电子的 存在有关,因而有人将 d 区元素的化学归结为 d 电子 的化学
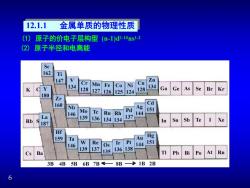
12.1.1 金属单质的物理性质 (1)原子的价电子层构型(m-1)d-10ns-2 (2)原子半径和电离能 Se 162 Ti 147 Zn Cr 134 Mn Fe Co Ni Cu 128 127 128 134 Ga Ge As Se 126 125124 Br Kr 180 Zr 160 Cd Nb Ag Pd 151 146 Mo Te Ru Rh 144 La 139 136 137 Rb 134134 Sn Sb Te Xe 187 In Hf 159 Ta Au Hg W Re Os Ir Pt 151 146 144 139 137 136138 Cs Ba 135 Pb Bi Po At Rn 3B 4B 5B 6B 7B8B>1B 2B 6
6 12.1.1 金属单质的物理性质 (2) 原子半径和电离能 (1) 原子的价电子层构型 (n-1)d1-10ns 1-2
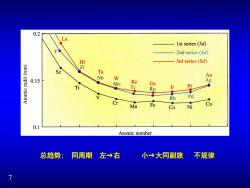
0.2 La 1st series(3d) Y 2nd series (4d) 红 3rd series(5d) Zr Sc 】 Ta Au 0.15 Mo Re Ag Os Ti Tc Pt Ru Ir RH Pd Mn Fe Cu Co Ni 0.1 Atomic number 总趋势:同周期 左→右 小→大同副族 不规律
7 总趋势: 同周期 左→右 小→大同副族 不规律

(3)金属单质的物理性质 ●熔点、沸点高 Se Cr Mn Fe Co Ni a Nb Mo Ge As Se Br Kr 熔点最高的单质: Pd 钨W)3683±20℃ Rb Sr a Re Sn Sb Te I Xe Hg TI Pb Bi Po At Rn 3B 4B 5B 6B 7B 8B 1B 2B ●硬度大 硬度最大的金属:铬(Cr)摩氏9.0 ●密度大 Cr Fe Co Ni Cu Zn K Ca Se Ti Ga Ge As Se Br Kr Rh 密度最大的单质: d 锇(0s)22.48gcm-3 Rb Sr In Sn Sb Te I xe Cs Ba TI Pb Bi Po At Rn 3B 4B 5B6B7B—8B>1B2B ●导电性,导热性,延展性好 8
8 (3) 金属单质的物理性质 ●硬度大 硬度最大的金属:铬(Cr) 摩氏 9.0 ●导电性,导热性,延展性好 ●熔点、沸点高 熔点最高的单质: 钨(W) 3683±20℃ ●密度大 密度最大的单质: 锇(Os ) 22.48 g·cm-3

(4 金属元素的原子化焓 Sc Ti Cr Mn Fe Co Ni Cu Zn 381 470 515 397 285 415 423 422 339 131 Y Zr Nb Mo Te Ru Rh Pd Ag Cd 420 593 752 659 661 650 558 373 285 112 a Hf Ta W Re Os Ir Pt Au 431 789 782 851 778 790 669 565 368 6 金属元素的原子化焓是金属内部原子结合力强弱的一种标志,较高 的原子化焓可能是由于较多的价电子(特别是较多的未成对电子)参与 形成金属键,这种结合力似乎也应该反映在过渡元素的上述物理性质上 9
9 (4) 金属元素的原子化焓 金属元素的原子化焓是金属内部原子结合力强弱的一种标志,较高 的原子化焓可能是由于较多的价电子(特别是较多的未成对电子)参与 形成金属键.这种结合力似乎也应该反映在过渡元素的上述物理性质上. 381 470 515 397 285 415 423 422 339 131 420 593 752 659 661 650 558 373 285 112 431 789 782 851 778 790 669 565 368 61

随周期数的增加,为什么s区元素化学 活性增加,而d区元素却化学活性减弱? 金属元素化学活性的大小,并非全由电离能定量给出.因为电 离能只能反映处于气态金属原子失去电子的难易.例如,比较一价 金属与酸溶液反应的难易,则与下列循环有关: △H M(s) M+(aq)+e △H △H △H △H=△H1+△H1+△H M(g) M+(g) e- s区元素从上到下总热效应△H(吸热)总的来说是变小的,这就 表明它们在水溶液中变成水合离子的倾向从上到下变大,而d区元 素从上到下总热效应△H(吸热)增大,因此它们的活性都变小, 如果反应不在溶液中进行,则应该比较金属的升华热,电离 能和相应的晶格能。通过相似的计算也可得到与上面相同的结论。 10
10 Question 1 随周期数的增加,为什么 s 区元素化学 活性增加,而 d 区元素却化学活性减弱? 金属元素化学活性的大小,并非全由电离能定量给出. 因为电 离能只能反映处于气态金属原子失去电子的难易. 例如,比较一价 金属与酸溶液反应的难易,则与下列循环有关: M(s) M+(aq) + e – △H M(g) M+(g) + e – △H1 △HI △Hh △H=△HI + △H1 + △Hh s 区元素从上到下总热效应 △H (吸热)总的来说是变小的,这就 表明它们在水溶液中变成水合离子的倾向从上到下变大,而 d 区元 素从上到下总热效应 △H (吸热)增大,因此它们的活性都变小. 如果反应不在溶液中进行,则应该比较金属的升华热,电离 能和相应的晶格能. 通过相似的计算也可得到与上面相同的结论
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西北大学:《普通化学》课程教学资源(PPT课件)第十一章 p区元素 p Block Elements(二).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十章 p区元素 p-block elements(一).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第八章 配位化合物 Coordination Compounds.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第七章 氧化还原反应 Oxidation-reduction reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第六章 电解质溶液和非电解质溶液 Electrolyte Solution and Non Electrolyte Solution.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第四章 化学热力学的初步概念与化学平衡 Primary Conception of Chemical Thermodynamics & Chemical Equilibrium.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第三章 化学反应速率与反应动力学的初步概念 Primary Conception of Chemical Reaction Rate and Reaction Kinetics.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第二章 化学键与化学结构 Chemical Bond And Molecular Structure.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十二章 稀土元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十一章 过渡金属(Ⅱ)§21.1 铁系元素 §21.2 铂系元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十章 过渡金属(I)§20.1 概述 §20.2 Ti副族 §20.3 钒副族 §20.4 铬副族 §20.5 锰副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十八章 铜、锌副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十七章 碱金属和碱土金属.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十六章 硼族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十五章 碳族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十四章 氮族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十三章 氧族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十二章 卤素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十一章 氧化还原反应.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十章 电解质溶液.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十三章 f区元素 f-Block Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)绪论 Inorganic Chemistry(主讲:刘洪).ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二章 分子结构 Molecular Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第三章 晶体结构 Crystal Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第四章 配位化合物 Coordination Compounds.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第五章 化学热力学基础 Primary Conception of Chemical Thermodynamics.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第六章 化学平衡常数 Equilibrium constant.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十一章 电化学基础 The basic of electronic-chemistry.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十二章 配位平衡 Coordination Equilibrium.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十四章 卤素 Halogen.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十五章 氧族元素 Oxygen family element.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十六章 氮磷砷 Nitrogen, Phosphorus and Arsenic.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十八章 非金属元素小结.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十九章 金属通论.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二十章 s区元素 s-Block Elements.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)分析化学绪论(授课人:丁杰).ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第一章 化学反应一般原理.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第二章 酸碱反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第三章 氧化还原反应.ppt
