西昌学院:《无机化学》课程教学资源(PPT课件)第五章 化学热力学基础 Primary Conception of Chemical Thermodynamics

第5章 化学热力学基础 Chapter 5 Primary Conception of Chemical Thermodynamics
第5章 化学热力学基础 Chapter 5 Primary Conception of Chemical Thermodynamics

本章要求 1、了解热力学的概况一反应是否发生;描述大量原子、 分子等微粒构成的宏观系统的行为。 2、建立与化学热力学有关的10个基本概念 3、了解化学热力学四个重要的状态函数 热力学能、吉 布斯自由能和嫡;建立标准摩尔反应焓、标准摩尔反应自 由能和标准熵以及标准摩尔反应熵的概念,并对化学反应 的方向和限度作初步讨论。 4、化学热力学的应用。包括计算反应焓、反应熵和反应自 由能;估算非常温下的反应自由能、热力学分解温度或反 应温度等;计算非标准反应自由能和反应温度等。 y 止页下页 节首节尾
2 1、了解热力学的概况——反应是否发生;描述大量原子、 分子等微粒构成的宏观系统的行为。 本章要求 2、建立与化学热力学有关的10个基本概念 3、了解化学热力学四个重要的状态函数——热力学能、吉 布斯自由能和熵;建立标准摩尔反应焓、标准摩尔反应自 由能和标准熵以及标准摩尔反应熵的概念,并对化学反应 的方向和限度作初步讨论。 4、化学热力学的应用。包括计算反应焓、反应熵和反应自 由能;估算非常温下的反应自由能、热力学分解温度或反 应温度等;计算非标准反应自由能和反应温度等

本章内容 5.1化学热化学的研究对象 5.2基本概念 5.3化学热力学的四个重要状态函数 5.4化学热力学的应用 上页下页节首节尾
3 5.2 基本概念 5.1 化学热化学的研究对象 5.3 化学热力学的四个重要状态函数 5.4 化学热力学的应用 本章内容

5-1化学热力学的研究对象 “热力学”发展史: 19世纪中叶,发明蒸汽机 ǒ 1884一热力学第一定律, 德物理学家Julius Robert Meger(迈尔); 1885 热力学第二定律, 德物理学家Rudolph Clausius(克劳修斯) 1851,英物理学家William w.whereyou.com Thomson Kermanm Nernst (能斯特) 止页下页 节首节尾 都江堰宝瓶口
4 5-1 化学热力学的研究对象 “热力学”发展史: R 19世纪中叶,发明蒸汽机 R 1884——热力学第一定律, 德物理学家Julius Robert Meger (迈尔); R 1885——热力学第二定律, 德物理学家Rudolph Clausius(克劳修斯); 1851,英物理学家William Thomson Kermanm Nernst (能斯特) 都江堰宝瓶口
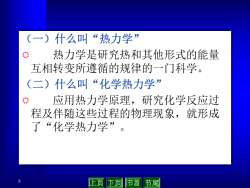
(一)什么叫“热力学” 热力学是研究热和其他形式的能量 互相转变所遵循的规律的一门科学。 (二)什么叫“化学热力学” 应用热力学原理,研究化学反应过 程及伴随这些过程的物理现象,就形成 了“化学热力学”。 止页下页节首节尾
5 (一)什么叫“热力学” R 热力学是研究热和其他形式的能量 互相转变所遵循的规律的一门科学。 (二)什么叫“化学热力学” R 应用热力学原理,研究化学反应过 程及伴随这些过程的物理现象,就形成 了“化学热力学”

(三)化学热力学解决什么问题 例:298.15K,各气体分压101.325KPa下, 女 N2(g)+3H2(g)=2NH3(g) △Gm/kJ/mol0 0 -16.5 △,Gmo=2(-16.5)-0-3×0=-33kJ/mol 女指定条件(标准状态)下,正反应自发进行。 1.反应的方向(△,Gm。<0?) 指定条件下,正反应可否自发进行: 上页下页 节首 节尾
6 (三)化学热力学解决什么问题 R 例:298.15K,各气体分压101.325KPa下, R N2 (g) + 3H2(g) = 2 NH3 (g) △fGm ø / kJ/mol 0 0 -16.5 △rGm ø = 2 (-16.5) – 0 –3× 0 = -33kJ/mol R 指定条件(标准状态)下,正反应自发进行。 R 1.反应的方向 (△rGm ø﹤0 ?) 指定条件下,正反应可否自发进行;
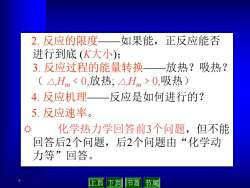
2.反应的限度 如果能,正反应能否 进行到底(K大小): 3.反应过程的能量转换 放热?吸热? (△,Hm0,吸热) 4.反应机理一 反应是如何进行的? 5.反应速率。 化学热力学回答前3个问题,但不能 回答后2个问题,后2个问题由“化学动 力等”回答。 上页下页 节首节尾
7 2. 反应的限度——如果能,正反应能否 进行到底 (K大小); 3. 反应过程的能量转换——放热?吸热? ( △rHm ﹤0,放热; △rHm﹥0,吸热) 4. 反应机理——反应是如何进行的? 5. 反应速率。 R 化学热力学回答前3个问题,但不能 回答后2个问题,后2个问题由“化学动 力等”回答

(四)热力学方法的特点 1.研究体系的宏观性质 即大量质点的平均行为,所得结论具有统计 意义;不涉及个别质点的微观结构及个体行为, 不依据物质结构的知识。 2.不涉及时间概念。 无机化学课的“化学热力学初步”,着重应 用热力学的一些结论,去解释一些无机化学现 象;严格的理论推导、详细地学习“化学热力 学”,是“物理化学”课程的任务之一。 上页 下页 节首 节尾
8 (四)热力学方法的特点 R 1.研究体系的宏观性质 R 即大量质点的平均行为,所得结论具有统计 意义;不涉及个别质点的微观结构及个体行为, 不依据物质结构的知识。 R 2.不涉及时间概念。 R 无机化学课的“化学热力学初步” ,着重应 用热力学的一些结论,去解释一些无机化学现 象;严格的理论推导、详细地学习“化学热力 学” ,是“物理化学”课程的任务之一

(五)热力学四大定律 热力学第一定律(能量守恒与转化定律) 一自然界的一 切物质都具有能量,能量有各种不同形式,能够从一种形 式转化为另一种形式,在转化中能量的总数量不变。或第 一类永动机是不可能造成的。 热力学第二定律一凡是自发过程都是不可逆的,而且 切不可逆过程都可以与热功交换的不可逆相联系。或第二 类永动机是不可能造成的。 克劳修斯:不可能把热从低温物体转到高温物体而不引起 其他变化。 开尔文:不可能从单一热源取出热使之完全变为功而不发 生其他变化。 上页下页 节首节尾
9 (五) 热力学四大定律 热力学第一定律 (能量守恒与转化定律) ——自然界的一 切物质都具有能量,能量有各种不同形式,能够从一种形 式转化为另一种形式,在转化中能量的总数量不变。或第 一类永动机是不可能造成的。 热力学第二定律 ——凡是自发过程都是不可逆的,而且一 切不可逆过程都可以与热功交换的不可逆相联系。或第二 类永动机是不可能造成的。 克劳修斯:不可能把热从低温物体转到高温物体而不引起 其他变化。 开尔文:不可能从单一热源取出热使之完全变为功而不发 生其他变化

热力学第零定律 如果两个热力学系统中的每一个都与 第三个热力学系统处于热平衡(温度相同),则它们彼此也 必定处于热平衡。热力学第零定律是进行体系测量的基本 依据。 热力学第三定律一 绝对零度不可达到但可以无限趋近。 热力学四大定律小总结:18世纪,卡诺等科学家发现在诸如机车 人体、太阳系和宇宙等系统中,从能量转变成功的四大定律。没有这 四大定律的知识,很多工程技术和发明就不会诞生。 热力学的四大定律简述如下: 热力学第零定律一如果两个热力学系统中的每一个都与第三个热力 学系统处于热平衡(温度相同,则它们彼此也必定处于热平衡。 热力学第一定律一 能量守恒定律在热学形式的表现。 热力学第二定律一 力学能可全部转换成热能,但是热能却不能以有 限次的实验操作全部转换成功(热机不可得)。 热力学第三定律 绝对零度不可达到但可以无限趋近。 10 上页下页 节首 节尾
10 热力学第零定律 ——如果两个热力学系统中的每一个都与 第三个热力学系统处于热平衡(温度相同),则它们彼此也 必定处于热平衡。热力学第零定律是进行体系测量的基本 依据 。 热力学第三定律 ——绝对零度不可达到但可以无限趋近。 热力学四大定律小总结:18世纪,卡诺等科学家发现在诸如机车、 人体、太阳系和宇宙等系统中,从能量转变成功的四大定律。没有这 四大定律的知识,很多工程技术和发明就不会诞生。 热力学的四大定律简述如下: 热力学第零定律-如果两个热力学系统中的每一个都与第三个热力 学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡。 热力学第一定律-能量守恒定律在热学形式的表现。 热力学第二定律-力学能可全部转换成热能, 但是热能却不能以有 限次的实验操作全部转换成功 (热机不可得)。 热力学第三定律-绝对零度不可达到但可以无限趋近
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西昌学院:《无机化学》课程教学资源(PPT课件)第四章 配位化合物 Coordination Compounds.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第三章 晶体结构 Crystal Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二章 分子结构 Molecular Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)绪论 Inorganic Chemistry(主讲:刘洪).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十三章 f区元素 f-Block Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十二章 d区元素 d-Blocks Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十一章 p区元素 p Block Elements(二).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十章 p区元素 p-block elements(一).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第八章 配位化合物 Coordination Compounds.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第七章 氧化还原反应 Oxidation-reduction reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第六章 电解质溶液和非电解质溶液 Electrolyte Solution and Non Electrolyte Solution.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第四章 化学热力学的初步概念与化学平衡 Primary Conception of Chemical Thermodynamics & Chemical Equilibrium.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第三章 化学反应速率与反应动力学的初步概念 Primary Conception of Chemical Reaction Rate and Reaction Kinetics.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第二章 化学键与化学结构 Chemical Bond And Molecular Structure.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十二章 稀土元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十一章 过渡金属(Ⅱ)§21.1 铁系元素 §21.2 铂系元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十章 过渡金属(I)§20.1 概述 §20.2 Ti副族 §20.3 钒副族 §20.4 铬副族 §20.5 锰副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十八章 铜、锌副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十七章 碱金属和碱土金属.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第六章 化学平衡常数 Equilibrium constant.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十一章 电化学基础 The basic of electronic-chemistry.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十二章 配位平衡 Coordination Equilibrium.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十四章 卤素 Halogen.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十五章 氧族元素 Oxygen family element.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十六章 氮磷砷 Nitrogen, Phosphorus and Arsenic.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十八章 非金属元素小结.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十九章 金属通论.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二十章 s区元素 s-Block Elements.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)分析化学绪论(授课人:丁杰).ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第一章 化学反应一般原理.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第二章 酸碱反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第三章 氧化还原反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第四章 原子结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第五章 分子结构和晶体结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第六章 配位化合物.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第七章 S区元素.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第八章 d区、ds区元素.ppt
- 《无机化学》课程教学资源(参考资料)ds区表格(铜、银、锌、镉、汞)重要化合物.doc
- 北京大学:《无机化学》课程教学课件(PPT讲稿)无机化学课程前言.ppt
