西昌学院:《无机化学》课程教学资源(PPT课件)第二章 分子结构 Molecular Structure

第2章: 分子结构 Chapter 2 Molecular Structure
Chapter 2 Molecular Structure 第 2 章 分子结构

本章教学要求 1.认识化学键的本质; 2.掌握价键理论的内容;会用价键理论解释共价键的特征,会用 价电子对互斥理论和杂化轨道理论解释简单的分子结构: 3.初步认识分子轨道,掌握第二周期元素的分子轨道特点; 4.认识分子间作用力和氢键的本质,会用其解释对物质性质的影 响。 上页下页节首节尾
2 本章教学要求 4.认识分子间作用力和氢键的本质,会用其解释对物质性质的影 响. 1.认识化学键的本质; 2.掌握价键理论的内容;会用价键理论解释共价键的特征,会用 价电子对互斥理论和杂化轨道理论解释简单的分子结构; 3.初步认识分子轨道,掌握第二周期元素的分子轨道特点;

本章教学内容 2.1化学键的定义 Definition of chemical bonding 2.2共价键的概念与路易斯Concept of the covalent bond 结构式 theory and Lewis'structure formula 2.3用以判断共价分子几何形VSEPR for judging the configuration 状的价层电子对互斥理论of the covalence molecular 2.4原子轨道的重叠一 价键Superposition of atomic orbital 理论 valence bond theory 2.5共轭大π键 Molecular orbital theory 2.6等电子体原理 Molecular orbital theory 2.7分子轨道理论 Molecular orbital theory 2.8共价分子的性质 Metallic bond theory 2.9分子间作用力和氢键 Intermolecular forces and hydrogen bonding 结束
2.1 化学键的定义 Definition of chemical bonding 2.2 共价键的概念与路易斯 结构式 Concept of the covalent bond theory and Lewis’ structure formula 2.8 共价分子的性质 Metallic bond theory 2.9 分子间作用力和氢键 Intermolecular forces and hydrogen bonding 本章教学内容 2.3 用以判断共价分子几何形 状的价层电子对互斥理论 VSEPR for judging the configuration of the covalence molecular 2.4 原子轨道的重叠 — 价键 理论 Superposition of atomic orbital — valence bond theory 2.7 分子轨道理论 Molecular orbital theory 2.5 共轭大π键 Molecular orbital theory 2.6 等电子体原理 Molecular orbital theory

2.1化学键的定义(definition of chemical bond) 2.1.1什么是化学键? sodium 2Na (s)+Cl(g) 2NaCl(s) Color 银灰色 黄绿色 无色 State 固体 气体 晶体 Electrical conductivity 极强 极弱 极弱 sodium 熔融导电 chloride Elective 无变化 无变化 熔融下反 应逆转 6 上边三种物质的性质的不同是由什么引起的?反映出什么问题? 上页下页节首节尾
4 2.1 化学键的定义 (definition of chemical bond) 2.1.1 什么是化学键? 2Na (s) + Cl2 (g) 2NaCl (s) Color State Electrical conductivity Elective 银灰色 黄绿色 无色 固体 气体 晶体 极强 极弱 极弱 熔融导电 无变化 无变化 熔融下反 应逆转 上边三种物质的性质的不同是由什么引起的?反映出什么问题? sodium sodium chloride

不同的外在性质反应了不同的内部结构 各自内部的结合力不同 Pauling L在中提出了用 得最广泛的化学键定义:如果两个原子(或原子团)之间的作用 力强得足以形成足够稳定的、可被化学家看作独立分子物种的聚 集体,它们之间就存在化学键,简单地说,化学键是指分子内部原 子之间的强相互作用力 化学键理论可以解释: 。分子的形成与稳定性 ●共价键的本质及饱和性 ·分子的几何构型和共价键的方向性 。化学键与分子的物化性质间的关系 上页下页 节首 节尾
5 Pauling L 在>中提出了用 得最广泛的化学键定义:如果两个原子(或原子团)之间的作用 力强得足以形成足够稳定的、可被化学家看作独立分子物种的聚 集体,它们之间就存在化学键.简单地说,化学键是指分子内部原 子之间的强相互作用力. 化学键理论可以解释: ● 分子的形成与稳定性 ● 共价键的本质及饱和性 ● 分子的几何构型和共价键的方向性 ● 化学键与分子的物化性质间的关系 不同的外在性质反应了不同的内部结构 各自内部的结合力不同
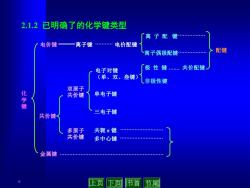
2.1.2已明确了的化学键类型 〔离子配 键 电价键一离子键 电价配键 离子偶极配键 配键 电子对键 极性键. 共价配键 (单、双、叁键) 非极性键 双原子 化 共价键 单电子键 三电子键 共价键 多原子 共轭π键 .4 共价键 多中心键 . 金属键 6 上页下页 节首节尾
6 化 学 键 共价键 金属键 离 子 配 键 离子偶极配键 离子键 电价配键 配键 双原子 共价键 多原子 共价键 电子对键 (单、双、叁键) 单电子键 三电子键 共轭 π 键 多中心键 极 性 键 共价配键 非极性键 2.1.2 已明确了的化学键类型 电价键
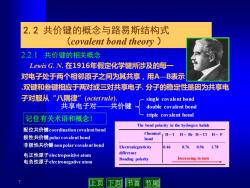
2.2共价键的概念与路易斯结构式 (covalent bond theory 2.2,1共价键的相关概念 Lewis G.N.在1916年假定化学键所涉及的每 对电子处于两个相邻原子之间为其共享,用八一B表示 双键和叁键相应于两对或三对共享电子.分子的稳定性是因为共享电 子对服从“八隅律”(octet rule), single covalent bond 共享电子对 共价键 double covalent bond 记住有关术语和概念】 triple covalent bond The bond polarity in the hydrogen halide 配位共价键coordination covalent bond Chemical H-I H-Br H-CI H-F 极性共价键polar covalent bond bond 非极性共价键non polar covalent bond Electronicgrativ ity 0.46 0.76 0.96 1.78 电正性原子electropositive atom diffe re nce Bonding polarity Increasing in turn 电负性原子electronegative atom 节尾
7 2.2.1 共价键的相关概念 2.2 共价键的概念与路易斯结构式 (covalent bond theory ) Lewis G. N. 在1916年假定化学键所涉及的每一 对电子处于两个相邻原子之间为其共享,用A—B表示 .双键和叁键相应于两对或三对共享电子. 分子的稳定性是因为共享电 子对服从“八隅律”(octet rule). 配位共价键coordination covalent bond 非极性共价键non polar covalent bond 极性共价键polar covalent bond 电负性原子electronegative atom 电正性原子electropositive atom 共享电子对——共价键 single covalent bond double covalent bond triple covalent bond The bond polarity in the hydrogen halide Chemical bond H – I H – Br H – Cl H – F Electronicgrativity 0.46 0.76 0.96 1.78 difference Bonding polarity Increasing in turn 记住有关术语和概念!

22.2路易斯结构式 路易斯用元素符号之间的小黑点表示分子中各原子的键合关 系,代表一对键电子的一对小黑点亦可用“一”代替。路易斯结 构式能够简洁地表达单质和化合物的成键状况,其基本书写步骤 空下微原子的键合关系写出元奏符井将相郎原子用单键连接在 大多数情况下,原子间的键合关系是已知的,例如,NO,中的 键合关系不是N一OO,而是O一N一O.有时还可作出某些有 根据的猜测。 2.将各原子的价电子数相加,算出可供利用的价电子总数.如果 被表达的物种带有正电荷,价电子总数应减去正电荷数:如果 被表达的物种带有负电荷,价电子总数应加上负电荷数, 3.扣除与共价单键相应的电子数(单键数×2)后,将剩余的价电 子分配给每个原子,使其占有适当数目的非键合电子。对第2 周期元素而言,非键合电子数与键合电子数之和往往能使每 个原子满足八隅律· 4.如果剩余的电子不够安排,可将一些单键改为双键或叁键 上页下页 节首 节尾
8 2.2.2 路易斯结构式 路易斯用元素符号之间的小黑点表示分子中各原子的键合关 系,代表一对键电子的一对小黑点亦可用“-”代替。路易斯结 构式能够简洁地表达单质和化合物的成键状况,其基本书写步骤 如下: 1. 按原子的键合关系写出元素符号并将相邻原子用单键连接. 在 大多数情况下,原子间的键合关系是已知的,例如, NO2中的 键合关系不是N—O—O,而是O—N—O.有时还可作出某些有 根据的猜测. 2. 将各原子的价电子数相加, 算出可供利用的价电子总数. 如果 被表达的物种带有正电荷, 价电子总数应减去正电荷数; 如果 被表达的物种带有负电荷, 价电子总数应加上负电荷数. 3. 扣除与共价单键相应的电子数(单键数×2)后,将剩余的价电 子分配给每个原子, 使其占有适当数目的非键合电子。对第2 周期元素而言, 非键合电子数与键合电子数之和往往能使每 个原子满足八隅律. 4. 如果剩余的电子不够安排,可将一些单键改为双键或叁键

Que 写出氯酸根离子CO3的路易斯结构式 C1原子的电负性小于0原子,意味着不存在O一O之间的键 合.合理的排布应该如下所示: C10离子中价电子总数等于26(四个原子的价电子数相加再加1), 扣除3个单键的6个电子,余下的20个电子以孤对方式分配给四个原 子,使它们均满足八隅律的要求 下页 节首 节尾
9 Question 写出氯酸根离子 ClO3 -的路易斯结构式. Cl 原子的电负性小于 O 原子,意味着不存在 O-O 之间的键 合. 合理的排布应该如下所示: ClO3 -离子中价电子总数等于26(四个原子的价电子数相加再加1), 扣除3个单键的6个电子,余下的20个电子以孤对方式分配给四个原 子, 使它们均满足八隅律的要求. Cl O O O Cl O O O

Que 写出NO离子的路易斯结构式 NO+离子只可能有一种排布方式,见下图最左边一个: N-O N汉* :+N+ N≡O:7 NO离子中价电子总数等于10(两个原子的价电子数相加后减 1),扣除1个单键的2个电子,余下的8个电子无论按上图中第 二个那样以孤对方式分配给两个原子,还是按上图中第三或第四 个那样将N一O单键改为双键,都不能使两个原子同时满足八隅 律的要求.这一要求只有将单键改为叁键才能满足, 10 上页 下页 节首 节尾
10 Question 写出 NO+ 离子的路易斯结构式. NO+ 离子只可能有一种排布方式,见下图最左边一个: NO+ 离子中价电子总数等于10 (两个原子的价电子数相加后减 1),扣除 1 个单键的 2 个电子, 余下的 8 个电子无论按上图中第 二个那样以孤对方式分配给两个原子,还是按上图中第三或第四 个那样将 N-O 单 键改为双键,都不能使两个原子同时满足八隅 律的要求. 这一要求只有将单键改为叁键才能满足. N O N O + + N O + N O + N O
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西昌学院:《无机化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)绪论 Inorganic Chemistry(主讲:刘洪).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十三章 f区元素 f-Block Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十二章 d区元素 d-Blocks Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十一章 p区元素 p Block Elements(二).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十章 p区元素 p-block elements(一).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第八章 配位化合物 Coordination Compounds.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第七章 氧化还原反应 Oxidation-reduction reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第六章 电解质溶液和非电解质溶液 Electrolyte Solution and Non Electrolyte Solution.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第四章 化学热力学的初步概念与化学平衡 Primary Conception of Chemical Thermodynamics & Chemical Equilibrium.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第三章 化学反应速率与反应动力学的初步概念 Primary Conception of Chemical Reaction Rate and Reaction Kinetics.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第二章 化学键与化学结构 Chemical Bond And Molecular Structure.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十二章 稀土元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十一章 过渡金属(Ⅱ)§21.1 铁系元素 §21.2 铂系元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第二十章 过渡金属(I)§20.1 概述 §20.2 Ti副族 §20.3 钒副族 §20.4 铬副族 §20.5 锰副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十八章 铜、锌副族.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十七章 碱金属和碱土金属.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十六章 硼族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十五章 碳族元素.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十四章 氮族元素.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第三章 晶体结构 Crystal Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第四章 配位化合物 Coordination Compounds.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第五章 化学热力学基础 Primary Conception of Chemical Thermodynamics.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第六章 化学平衡常数 Equilibrium constant.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十一章 电化学基础 The basic of electronic-chemistry.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十二章 配位平衡 Coordination Equilibrium.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十四章 卤素 Halogen.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十五章 氧族元素 Oxygen family element.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十六章 氮磷砷 Nitrogen, Phosphorus and Arsenic.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十八章 非金属元素小结.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十九章 金属通论.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二十章 s区元素 s-Block Elements.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)分析化学绪论(授课人:丁杰).ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第一章 化学反应一般原理.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第二章 酸碱反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第三章 氧化还原反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第四章 原子结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第五章 分子结构和晶体结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第六章 配位化合物.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第七章 S区元素.ppt
