四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第二章 酸碱反应

第二章 日 酸碱反应 [引]本章应用反应一般原理,讨论无机物在水溶液 中的反应规律。 [特点]反应速度较大,故重点集中在反应的方向和限 度上。 [思考]标题含义。 第一节酸碱理论 电离理论(归纳) 1、 立论点:水溶液中物质的离解。 2、要点: ①电离:电解质在水中或熔融状态下离解为自 由移动的离子的过程。 ②酸:在水溶液中电离产生的阳离子全部是H中 的化合物;阴离子全部是0H的化合物是碱
第二章 酸碱反应 [引] 本章应用反应一般原理,讨论无机物在水溶液 中的反应规律。 [特点]反应速度较大,故重点集中在反应的方向和限 度上。 [思考]标题含义。 第一节 酸碱理论 一、 电离理论(归纳) 1、立论点:水溶液中物质的离解。 2、要点: ①电离:电解质在水中或熔融状态下离解为自 由移动的离子的过程。 ②酸:在水溶液中电离产生的阳离子全部是H+ 的化合物;阴离子全部是OH—的化合物是碱

即:H是酸的特征,OH一是碱的特征。 ③酸碱反应的实质: H和OH结合成水,另一产物称为盐。 二、 质子理论 1、立论点:物质与质子的关系。 2、要点: (1)酸、碱定义: 酸—凡能给出质子的物种 碱一凡能接受质子的物种 两性物—既可给出、亦可接受质子的物种 (2)共轭关系 质子酸一H+质子碱 酸中有碱,碱可变酸 对应互变关系
即:H+是酸的特征,OH—是碱的特征。 ③ 酸碱反应的实质: H+和OH—结合成水,另一产物称为盐。 二、质子理论 1、立论点:物质与质子的关系。 2、要点: ⑴酸、碱定义: 酸——凡能给出质子的物种 碱——凡能接受质子的物种 两性物——既可给出、亦可接受质子的物种 ⑵共轭关系: 质子酸 H+ + 质子碱 酸中有碱,碱可变酸——对应互变关系

(3)相对强弱:给出或接受质子的相对能力 相互制约关系—共轭的必然结果 (4)酸碱反应 实质:质子在两共轭酸碱对之间的转移或传递。 [简评] 它揭示了酸碱的对立统一关系,扩大了酸碱范围,解 决了非水体系的酸碱及反应问题。 第二节水溶液的酸碱性 一、水的离解(溶剂质子自递) 1.Kw一水离子积常数 2.Kw的意义 它把酸碱对立统一关系联系起来了。 3.K的性质:为温度的函数
⑶相对强弱:给出或接受质子的相对能力 相互制约关系——共轭的必然结果 ⑷酸碱反应 实质:质子在两共轭酸碱对之间的转移或传递。 [简评] 它揭示了酸碱的对立统一关系,扩大了酸碱范围,解 决了非水体系的酸碱及反应问题。 第二节 水溶液的酸碱性 一、水的离解(溶剂质子自递) 1. Kw——水离子积常数 2. Kw的意义 它把酸碱对立统一关系联系起来了。 3. Kw的性质:为温度的函数

二、酸碱性: [H门=[OH]中性,[H]>[OH酸性,[H中<[OH]碱性 三、PH值(POH值) [思考] “PH=7.5的水溶液,是碱性溶液” “酸性溶液仅存在H中,碱性溶液仅存在OH” “中性溶液的含义是什么?” 酸浓度、酸度、酸强度、酸性 四、拉平效应,区分效应 分析:HCL,HNO3,HCIO4等酸在H,O中的表现 NH3,NaOH在水中的表现 四、计算(室温) ①0.01mo1/0HCI的PH值 ②10-8mo1/0HCI的PH值
二、酸碱性: [H+ ]=[OH- ]中性,[H+ ]>[OH- ]酸性,[H+ ]<[OH- ]碱性 三、PH值(POH值) [思考] “PH=7.5的水溶液,是碱性溶液” “酸性溶液仅存在H+,碱性溶液仅存在OH-” “中性溶液的含义是什么?” 酸浓度、酸度、酸强度、酸性 四、拉平效应,区分效应 分析:HCl,HNO3 ,HClO4等酸在H2O中的表现 NH3,NaOH在水中的表现 四、计算(室温) ①0.01 mol/ HCl的PH值 ②10-8 mol/ HCl的PH值

第三节酸碱平衡 一、 电离平衡 弱酸(碱)在水中的电离 1、电离常数 表征了弱酸(碱)电离程度,仅为温度的函数。 2、多元酸碱离解的特点 ①电离过程是分步进行的; ②各级电离常数显著减小。 3、有关计算 例:计算105MHAc溶液的H和电离度Ka=1.8×10-5) 例:求室温饱和硫化氢水溶液的[H]、[OH]、[S2]、 [HS]及电离度。K1=10-8K2=10-15 例:计算0.1MH2SO4溶液的[H]、[SO42]。 K=1.2×10-2
第三节 酸碱平衡 一、电离平衡——弱酸(碱)在水中的电离 1、电离常数 表征了弱酸(碱)电离程度,仅为温度的函数。 2、多元酸碱离解的特点 ①电离过程是分步进行的; ②各级电离常数显著减小。 3、有关计算 例:计算10-5MHAc溶液的[H+ ]和电离度(Ka=1.8×10-5 ) 例:求室温饱和硫化氢水溶液的[H+ ]、[OH- ]、[S2- ]、 [HS- ]及电离度。K1=10-8 K2=10-15 例:计算0.1M H2SO4溶液的[H+ ]、[SO4 2- ]。 K=1.2×10-2
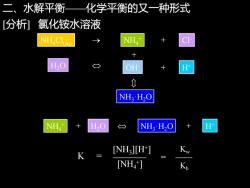
二、水解平衡 化学平衡的又一种形式 [分析] 氯化铵水溶液 NH" + O H+ 0 NH3H2O NH H,O NH,H2O H INH ][H-] [NH4]
二、水解平衡——化学平衡的又一种形式 [分析] 氯化铵水溶液 NH3·H2O + NH4Cl(aq) NH4 + Cl → + - H OH- H+ 2O + NH4 + H H+ + 2O NH3·H2O + K = ———— [NH3 ][H+ ] [NH4 + ] = Kw Kb ——

1、水解常数Kh 表征了盐水解程度大小,亦仅为温度的函数。 弱碱强酸盐:Kh=Kw/Kb弱酸强碱盐:Kh=Kw/K 弱酸弱碱盐:K=Kw/K,K 般Kh并不大。 2、有关计算 多元盐水解计算与多元酸碱电离相似,只考虑第一级 水解。 例:计算0.1MNH,CI的PH值(室温) 例:计算0.1MNa2CO3的PH值(室温)。 [注弱减弱酸盐及酸式盐计算不要求,只作定性分析
1、水解常数Kh 表征了盐水解程度大小,亦仅为温度的函数。 弱碱强酸盐:Kh=Kw/Kb 弱酸强碱盐: Kh=Kw/Ka 弱酸弱碱盐:Kh=Kw/Kb ·Ka 一般Kh并不大。 2、有关计算 多元盐水解计算与多元酸碱电离相似,只考虑第一级 水解。 例:计算0.1M NH4Cl的PH值(室温)。 例:计算0.1M Na2CO3的PH值(室温)。 [注]弱减弱酸盐及酸式盐计算不要求,只作定性分析

三、沉淀平衡—多相体系 [分析难溶物在水中的溶解过程(BaSO4) BaS04s÷Baam2+S042al 平衡时:Kc=[Ba2+][SO42]=Ksp 1、溶度积常数Ksp—难溶物溶解平衡定量特征 Ksp反映了物质在水中的溶解能力。 2、溶度积规则 Qi(离子积)=Ksp 平衡 Qi≠Ksp 非平衡 Qi>Ksp直至Q#=Ksp即沉淀生成 Q<Ksp直至Qi*=Ksp即沉淀溶解 3、溶解度与Ksp的关系 [问题]不同难溶物能否直接用Ksp比较溶解能力
三、沉淀平衡——多相体系 [分析]难溶物在水中的溶解过程(BaSO4 ) BaSO4(S) Ba(aq) 2+ + SO4 2- (aq) 平衡时:Kc = [Ba2+] [SO4 2- ] = Ksp 1、溶度积常数Ksp——难溶物溶解平衡定量特征 Ksp反映了物质在水中的溶解能力。 2、溶度积规则 Qi(离子积) = Ksp 平衡 Qi≠ Ksp 非平衡 Qi> Ksp 直至Qi# = Ksp 即沉淀生成 Qi< Ksp 直至Qi* = Ksp 即沉淀溶解 3、溶解度与Ksp的关系 [问题] 不同难溶物能否直接用Ksp比较溶解能力

例:难溶物氯化银和铬酸银在水中溶解度大小 KSPAgCI=1.56×10-10 KSpA2Co4=9×10-12 相同类型难溶物可直接用Ks比较溶解度大小。 4、溶度积规则应用 例:等体积的4×10-3 M AgNO3和K2CO4混合是否有 Ag2CrO4沉淀生成?KSPAR20o4=9×1012 [注]①、人眼对混浊度的敏感度1×10-5gml; ②、可能存在过饱和状态。 例:已知Ca3PO4)2的Ksp=2×10-29,求: ①、它在纯水中的溶解度$; ②、它在0.1 M NaPO4溶液中的溶解度。 5、分步沉淀与沉淀转化 [前提]不考虑反应速度
例:难溶物氯化银和铬酸银在水中溶解度大小 KspAgCl= 1.56×10-10 KspAg2CrO4= 9×10-12 相同类型难溶物可直接用Ksp比较溶解度大小。 4、溶度积规则应用 例:等体积的4×10-3 M AgNO3和K2CrO4混合是否有 Ag2CrO4沉淀生成? KspAg2CrO4= 9×10-12 [注] ①、人眼对混浊度的敏感度 1×10-5 g/ml; ②、可能存在过饱和状态。 例:已知Ca3 (PO4 )2的Ksp= 2×10-29 ,求: ①、它在纯水中的溶解度S; ②、它在0.1M Na3PO4溶液中的溶解度。 5、分步沉淀与沉淀转化 [前提]不考虑反应速度

①分步沉淀:在混合溶液中加入沉淀剂,被沉淀离子 先后沉淀的现象。 例:浓度均为0.1MC、CrO42-混合溶液,加入Ag, 谁先沉淀? [问题]当第二种离子开始沉淀时,溶液中另一种离子 尚存多少? [小结掌握了分步沉淀的规律,可控制适当条件,实 现分离的目的。 ②沉淀转化:由一种沉淀转化为另一种沉淀的过程。 遵守溶度积规则。 例:讨论碳酸钡转化为铬酸钡的条件。 KSPBaco3=5.1×10-9 KsPBacro4=1.2×10-10 [思考]能否实现硫酸钡向碳酸钡的转化? KSPBaco3=5.1×10-9 KSPBaso4=1.2×10-10
①分步沉淀:在混合溶液中加入沉淀剂,被沉淀离子 先后沉淀的现象。 例:浓度均为0.1M Cl-、CrO4 2-混合溶液,加入Ag+ , 谁先沉淀? [问题]当第二种离子开始沉淀时,溶液中另一种离子 尚存多少? [小结]掌握了分步沉淀的规律,可控制适当条件,实 现分离的目的。 ②沉淀转化:由一种沉淀转化为另一种沉淀的过程。 遵守溶度积规则。 例:讨论碳酸钡转化为铬酸钡的条件。 KspBaCO3= 5.1×10-9 KspBaCrO4= 1.2×10-10 [思考] 能否实现硫酸钡向碳酸钡的转化? KspBaCO3= 5.1×10-9 KspBaSO4= 1.2×10-10
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第一章 化学反应一般原理.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)分析化学绪论(授课人:丁杰).ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二十章 s区元素 s-Block Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十九章 金属通论.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十八章 非金属元素小结.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十六章 氮磷砷 Nitrogen, Phosphorus and Arsenic.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十五章 氧族元素 Oxygen family element.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十四章 卤素 Halogen.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十二章 配位平衡 Coordination Equilibrium.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十一章 电化学基础 The basic of electronic-chemistry.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第六章 化学平衡常数 Equilibrium constant.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第五章 化学热力学基础 Primary Conception of Chemical Thermodynamics.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第四章 配位化合物 Coordination Compounds.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第三章 晶体结构 Crystal Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二章 分子结构 Molecular Structure.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)绪论 Inorganic Chemistry(主讲:刘洪).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十三章 f区元素 f-Block Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十二章 d区元素 d-Blocks Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十一章 p区元素 p Block Elements(二).ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第三章 氧化还原反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第四章 原子结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第五章 分子结构和晶体结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第六章 配位化合物.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第七章 S区元素.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第八章 d区、ds区元素.ppt
- 《无机化学》课程教学资源(参考资料)ds区表格(铜、银、锌、镉、汞)重要化合物.doc
- 北京大学:《无机化学》课程教学课件(PPT讲稿)无机化学课程前言.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第一章 酸碱化学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第二章 配合物基础和配位立体化学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第三章 配位场理论和配合物的电子光谱.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第四章 配合物反应机理和动力学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第五章 非金属原子簇化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第六章 主族元素的有机金属化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第七章 金属羧基和π酸配体化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第八章 过渡金属有机化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第九章 配位催化反应.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第十章 金属原子簇和金属多重键.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)无机化学复习总结.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第一章 绪论 Organic Chemistry.ppt
