北京大学:《无机化学》课程教学课件(PPT讲稿)第九章 配位催化反应

第9章配位催化反应 均相催化反应,有机金属化合物参与,经过一系列反 应 ·起催化作用的金属有机化合物必须是配位不饱和 coordinative unsaturation) ·起始物有活性(activated precursors) 加热时配体可失去,Tolman锥角大(例如,PPh3,145°)
第9章 配位催化反应 • 均相催化反应,有机金属化合物参与,经过一系列反 应 • 起催化作用的金属有机化合物必须是配位不饱和 (coordinative unsaturation) • 起始物有活性 ( activated precursors ) 加热时配体可失去, Tolman锥角大( 例如, PPh3 , 145°)

RhCI(PPh3s←→RhCl(PPh32+PPh3(25°C) K=2.3×10-7 Tx2 RhCl(PPh33←→Rh2(μ-CD)2(PPh.34 ·给体(donor)的π酸性强度 π酸性小,反馈键弱,活性大 PPh3比CO和PCl3的π酸性小,活性大 RhCI(PPh3)3 +C2H<>RhCI (C2H4)(PPh3)2+PPh3 (解离) RhCI(PEts3+C2H4←→RhCl(C2H4)PEt3 加成)
RhCl(PPh3 )3 RhCl(PPh3 )2 + PPh3 (25 °C) K=2.3×10–7 T↗ 2RhCl(PPh3 )3 Rh2 (–Cl)2 (PPh3 )4 • 给体 (donor)的酸性强度 酸性小, 反馈键弱, 活性大 PPh3比CO和PCl3的酸性小, 活性大 RhCl(PPh3 )3 +C2H4 RhCl (C2H4 )(PPh3 )2 + PPh3 (解离) RhCl(PEt3 )3 +C2H4 RhCl (C2H4 )(PEt3 )3 (加成)

·配体L的大小决定配位数和反应活性 NiL4←→NiL3+L 当L=PPh3时,溶液中的NiL4全部解离为NL3 本章要点: 一,过渡金属有机化合物的基本反应 二.配位催化反应
• 配体L的大小决定配位数和反应活性 NiL4 NiL3+L 当L=PPh3时, 溶液中的NiL4全部解离为NiL3 本章要点: 一. 过渡金属有机化合物的基本反应 二. 配位催化反应

过渡金属有机化合物的基本反应 配体的解离和取代 氧化加成 还原消除 插入和迁移 对配体的亲核反应
一. 过渡金属有机化合物的基本反应 配体的解离和取代 氧化加成 还原消除 插入和迁移 对配体的亲核反应

l.氧化加成反应(oxidation addition) (配位不饱和) 氧化态在加成反应过程中是否改变 非氧化加成 PFs+F→PF6(氧化态不变,非氧化加成) PdCL42-+C→PdCl3(氧化态不变,非氧化加成) TiCl+2POCI3->TiCl(POCl)2
1. 氧化加成反应(oxidation addition) (配位不饱和) 氧化态在加成反应过程中是否改变 非氧化加成 PF5+F–⎯→ PF6 – ( 氧化态不变, 非氧化加成) PdCl4 2– +Cl–⎯→ PdCl5 3– ( 氧化态不变, 非氧化加成) TiCl4 + 2POCl3 ⎯→ TiCl4 (POCl3 ) 2

氧化加成: Fe(CO)s+Ht→Fe(CO)sH (质子化,氧化态由0→+2) Mn(CO)s-+H+->Mn(CO)sH (质子化,氧化态由-1→+1) P℉3+F2→P℉5(氧化态由+3→+5) SnCl2+Cl2→SnCl4(氧化态由+2→+4)
氧化加成: Fe(CO)5+H+ ⎯→ Fe(CO)5H+ (质子化, 氧化态由0 ⎯→ +2) Mn(CO)5 – +H+ ⎯→ Mn(CO)5H (质子化, 氧化态由 –1 ⎯→ +1) PF3+F2⎯→ PF5 ( 氧化态由+3 ⎯→ +5) SnCl2+Cl2 ⎯→ SnCl4 ( 氧化态由+2 ⎯→ +4)
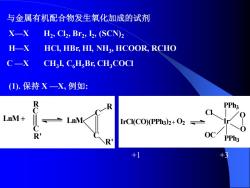
与金属有机配合物发生氧化加成的试剂 X一X H2,Cl2,Br2,I2,(SCN)2 H-X HCI,HBr,HI,NH3,HCOOR,RCHO C—X CHI,CHBr,CHCOCI (1).保持X—X,例如: R PPh3 C LnM+ LnM IrCI(CO)(PPh3)2+O2 R OC R PPh3 +1 +3
与金属有机配合物发生氧化加成的试剂 X—X H2 , Cl2 , Br2 , I2 , (SCN)2 H—X HCl, HBr, HI, NH3 , HCOOR, RCHO C —X CH3 I, C6H5Br, CH3COCl (1). 保持 X —X, 例如: LnM C C R R' LnM C R C R' + IrCl(CO)(PPh3 ) 2 + O2 Ir PPh3 PPh3 Cl OC O O +1 +3
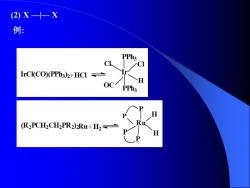
(2)X—十-X 例: PPh3 C IrCl(CO)(PPh3)2+HCI= OCPPh3 (R2PCH2CHPR2)Ru+H2
(2) X —|— X 例:

(3).已经是18电子构型的,氧化加成时排除一个配体 例:Ru(CO)4PMe)+CHI→Ru(CH3)D(CO)3PMe3)+CO 18e(0) 18e(+2)
(3). 已经是18电子构型的,氧化加成时排除一个配体 例: Ru(CO)4 (PMe3 ) + CH3 I ⎯→ Ru(CH3 )(I)(CO)3 (PMe3 ) + CO 18e ( 0 ) 18e(+2)
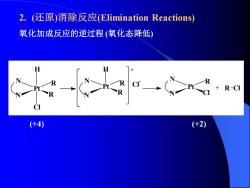
2.(还原)消除反应(Elimination Reactions) 氧化加成反应的逆过程(氧化态降低) R-CI (+4) (+2)
2. (还原)消除反应(Elimination Reactions) 氧化加成反应的逆过程 (氧化态降低) Pt R R H Cl N N N N H R Pt R + Cl - N N R Pt Cl + R Cl (+4) (+2)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第八章 过渡金属有机化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第七章 金属羧基和π酸配体化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第六章 主族元素的有机金属化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第五章 非金属原子簇化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第四章 配合物反应机理和动力学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第三章 配位场理论和配合物的电子光谱.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第二章 配合物基础和配位立体化学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第一章 酸碱化学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)无机化学课程前言.ppt
- 《无机化学》课程教学资源(参考资料)ds区表格(铜、银、锌、镉、汞)重要化合物.doc
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第八章 d区、ds区元素.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第七章 S区元素.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第六章 配位化合物.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第五章 分子结构和晶体结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第四章 原子结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第三章 氧化还原反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第二章 酸碱反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第一章 化学反应一般原理.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)分析化学绪论(授课人:丁杰).ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二十章 s区元素 s-Block Elements.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第十章 金属原子簇和金属多重键.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)无机化学复习总结.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第一章 绪论 Organic Chemistry.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第二章 烷烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第四章 二烯烃和炔烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第五章 脂环烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第八章 立体化学.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第九章 卤代烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十章 醇、酚、醚 Alcohol, Phenol and Ether.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十二章 羧酸及其衍生物 Carboxylic acids and derivatives.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十三章 取代羧酸.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十四章 含氮化合物.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十五章 含硫、磷和硅的有机化合物.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十六章 杂环化合物 Heterocyclic compounds.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十七章 周环反应 Pericyclic reaction.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十八章 碳水化合物 carbohydrates.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第二十章 类脂化合物 Lipids.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第二十一章 有机合成 Organic synthesis.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第二章 烷烃和环烷烃.ppt
