北京大学:《无机化学》课程教学课件(PPT讲稿)第四章 配合物反应机理和动力学

第4章配合物反应机理和动力学 配体取代(交换反应) 两类 电子转移反应(氧化还原反应)Taube,Marcus 反应机理的研究 >研究对象:Co3+,Cr3+,N2+Pt2+等中心离子,简单配体 >研究的时标(time scale)范围: 100s(惰性化合物) 配体交换 ms(活性化合物) μs(电荷迁移和电子转移)
第4章 配合物反应机理和动力学 反应 机理的研究 ➢ 研究对象: Co3+ , Cr3+ , Ni2+ ,Pt2+等中心离子, 简单配体 ➢ 研究的时标(time scale )范围: 100s (惰性化合物) ms (活性化合物) s (电荷迁移和电子转移) 配体取代 (交换反应) 电子转移反应(氧化还原反应)Taube , Marcus 两类 配体交换

一.配位取代(substitution)反应 反应机理: 计量关系,速率方程 深层次的机理研究,影响反应速率的因素 中心离子的电子结构LFSE,HS,LS),价态,半径 离去基团(leaving group))(和M的作用) 进入基团(entering group)(有影响或者无影响)》 旁位基团(spectator ligands)(例如,对位效应) 空间效应(steric effects)
一.配位取代(substitution)反应 反应机理: ➢ 计量关系, 速率方程 ➢ 深层次的机理研究,影响反应速率的因素 中心离子 的电子结构(LFSE, HS, LS), 价态, 半径 离去基团(leaving group) ( 和M的作用) 进入基团(entering group) (有影响或者无影响) 旁位基团(spectator ligands) (例如, 对位效应) 空间效应(steric effects)
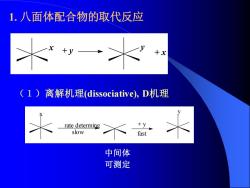
1.八面体配合物的取代反应 (1)离解机理(dissociative),D机理 rate determing +y slow fast 中间体 可测定
1. 八面体配合物的取代反应 + y y + x x (1)离解机理(dissociative), D机理 x rate determing slow + y y fast 中间体 可测定

Y的浓度和性质无关,只与起始配合物的浓度有关,因此 速率方程为: 反应速率=kML5X] (速率方程与进入基团y的浓度无关,S、单分子亲核) Co(CN)sH2O2- 1 K2 Co(CN)2-+H2O Co(CN)2-+Y- K3 ≤K4 Co(CN)sY3- Y-分别为Br,SCN,N3时,k值均为1.6×103s 说明反应与进入基团无关
Y的浓度和性质无关,只与起始配合物的浓度有关,因此 速率方程为: 反应速率= k[ML5 X] ( 速率方程与进入基团y的浓度无关,SN1单分子亲核) Co(CN)5H2O2− Co(CN)5 2− + H2O Co(CN)5 2− + Y− Co(CN)5Y3− k1 k2 k3 k4 Y−分别为Br− , I− , SCN− , N3 −时, k1值均为1.610−3 s −1 说明反应与进入基团无关
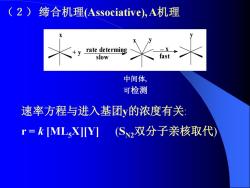
(2)缔合机理Associative),A机理 y rate determing slow 中间体, 可检测 速率方程与进入基团y的浓度有关: r=kMLX]Y](S2双分子亲核取代)
(2) 缔合机理(Associative), A机理 中间体, 可检测 x rate determing slow + y y fast x y _ x 速率方程与进入基团y的浓度有关: r = k [ML5X][Y] (SN2双分子亲核取代)
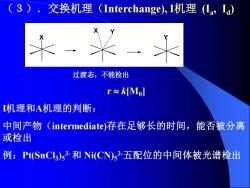
(3).交换机理(Interchange),I机理(Ia,Ia) 过渡态,不能检出 r≈kMl I机理和A机理的判断: 中间产物(intermediate)存在足够长的时间,能否被分离 或检出 例:Pt(SnCl3:)s3-和Ni(CN)s3-五配位的中间体被光谱检出
(3).交换机理(Interchange), I机理 (Ia , Id ) X Y X Y 过渡态,不能检出 r k[M0 ] I机理和A机理的判断: 中间产物(intermediate)存在足够长的时间,能否被分离 或检出 例:Pt(SnCl3 )5 3-和 Ni(CN)5 3-五配位的中间体被光谱检出
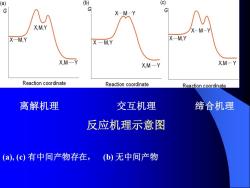
(a) G X-M-Y G X,M,Y X-M-Y X-M,Y X-M.Y X-MY XM-Y XM-Y XM-Y Reaction coordinate Reaction coordinate Reaction coordinate 离解机理 交互机理 缔合机理 反应机理示意图 (a),(c)有中间产物存在, (b)无中间产物
离解机理 交互机理 缔合机理 反应机理示意图 (a), (c) 有中间产物存在, (b) 无中间产物
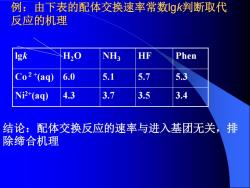
例:由下表的配体交换速率常数gk判断取代 反应的机理 Igk H20 NH3 HF Phen Co2+(aq) 6.0 5.1 5.7 Ni2+(aq) 4.3 3.7 3.5 .4 结论:配体交换反应的速率与进入基团无关,排 除缔合机理
例:由下表的配体交换速率常数lgk判断取代 反应的机理 lgk H2O NH3 HF Phen Co2+ (aq) 6.0 5.1 5.7 5.3 Ni2+(aq) 4.3 3.7 3.5 3.4 结论:配体交换反应的速率与进入基团无关,排 除缔合机理
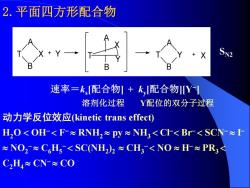
2.平面四方形配合物 9- X 速率=k,配合物+k,配合物Y】 溶剂化过程 Y配位的双分子过程 动力学反位效应kinetic trans effect) H,O<OH<F-≈RNH2≈py≈NH3<Cr<Br<SCN≈I ≈NO2≈C6H5<SCNH2)2≈CH3<NO≈H≈PR3< C2H4≈CN-≈CO
2.平面四方形配合物 B X A T B Y A T + Y A B T X Y + X 速率=ks [配合物] + ky [配合物][Y− ] 溶剂化过程 Y配位的双分子过程 动力学反位效应(kinetic trans effect) H2O OH− F− RNH2 py NH3 Cl− Br− SCN− I − NO2 − C6H5 − SC(NH2 ) 2 CH3 − NO H− PR3 C2H4 CN− CO SN2

NH3 NH3 NH3 NHg NH3 HgN 反位效应 NH3 Cr C NH3 H cr CI NH;CH HaN CI C CI-PK NHNO2→ C NH3 Pt NO2 反位效应 CI<NO2 NO2
Pt Cl Cl Cl Cl NH3 Cl Pt NH3 Cl Cl NH3 Pt NH3 Cl Cl NH3 Pt Pt C NH3 l Pt NH3 Cl NH3 NH3 H3 N H3 N H3 N NH3 H Cl 3 N Cl - Cl - Pt Cl Cl Cl Cl NH3 Cl Pt NH3 Cl Cl Pt NO2 Cl Cl NH3 NO2 - NO2 - NO2 H3N Cl Pt Cl Cl Cl Cl Cl Pt NO2 Cl Cl NH3 Pt Cl 反位效应 NH3 Cl− 反位效应 Cl− NO2 −
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第三章 配位场理论和配合物的电子光谱.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第二章 配合物基础和配位立体化学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第一章 酸碱化学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)无机化学课程前言.ppt
- 《无机化学》课程教学资源(参考资料)ds区表格(铜、银、锌、镉、汞)重要化合物.doc
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第八章 d区、ds区元素.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第七章 S区元素.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第六章 配位化合物.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第五章 分子结构和晶体结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第四章 原子结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第三章 氧化还原反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第二章 酸碱反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第一章 化学反应一般原理.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)分析化学绪论(授课人:丁杰).ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二十章 s区元素 s-Block Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十九章 金属通论.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十八章 非金属元素小结.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十六章 氮磷砷 Nitrogen, Phosphorus and Arsenic.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十五章 氧族元素 Oxygen family element.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十四章 卤素 Halogen.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第五章 非金属原子簇化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第六章 主族元素的有机金属化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第七章 金属羧基和π酸配体化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第八章 过渡金属有机化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第九章 配位催化反应.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第十章 金属原子簇和金属多重键.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)无机化学复习总结.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第一章 绪论 Organic Chemistry.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第二章 烷烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第四章 二烯烃和炔烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第五章 脂环烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第八章 立体化学.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第九章 卤代烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十章 醇、酚、醚 Alcohol, Phenol and Ether.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十二章 羧酸及其衍生物 Carboxylic acids and derivatives.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十三章 取代羧酸.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十四章 含氮化合物.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十五章 含硫、磷和硅的有机化合物.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十六章 杂环化合物 Heterocyclic compounds.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十七章 周环反应 Pericyclic reaction.ppt
