北京大学:《无机化学》课程教学课件(PPT讲稿)第三章 配位场理论和配合物的电子光谱

第3章.配位场理论和配合物的电子光谱 一.d轨道在配位场中的能级分裂(电子光谱的 基础和来源) 二.过渡金属配合物的电子光谱,△大小的表征 一 电子光谱(吸收光谱,紫外可见光谱), T一S图 三.电荷迁移光谱(charge transfer,CT光谱)
第3章. 配位场理论和配合物的电子光谱 一.d 轨道在配位场中的能级分裂(电子光谱的 基础和来源) 二.过渡金属配合物的电子光谱,O大小的表征 ―电子光谱(吸收光谱,紫外可见光谱), T―S图 三.电荷迁移光谱(charge transfer,CT光谱)

一.d轨道在配位场中的能级分裂 影响分裂能的因素: 10Dg=f千igand8ion 1.配位场的强度,配体,光谱化学系列 I-<Br-<S2<SCN-<CI<NO3<F-<OH ox2-<H,0 NCS-<CH2CN<NH3 <en dipy phen NO2<PR3<CN-<CO 2.金属离子Mnt,n越大,分裂能越大
一 .d 轨道在配位场中的能级分裂 影响分裂能的因素: 10Dq=fligand g ion 1.配位场的强度,配体,光谱化学系列 I − Br− S 2− SCN− Cl− NO3 − F − OH− ox2− H2 O NCS− CH3 CN NH3 en dipy phen NO2 − PR3 CN− CO 2.金属离子M n+,n越大,分裂能越大

3.周期数越高,分裂能越大,Pt2+,Ni2+ 4.不同的配位场中: 平面四方>八面体>四面体> PtCl D4h) NiCl2 (Td) Ni (CN)2-(D4h) (6周期) (4周期) C1(弱) CN(强)
3.周期数越高,分裂能越大, Pt2+, Ni2+ 4.不同的配位场中: 平面四方八面体四面体 PtCl4 2– ( D4h) NiCl4 2– (Td) Ni(CN)4 2–(D4h) (6周期) (4周期) Cl (弱) CN–(强)
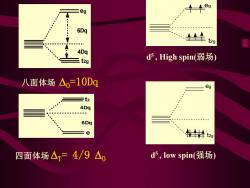
eg 十+eg 6Dq t2g 4Dq t2g d5,High spin(弱场) 八面体场△=10Dg eg 三t2 4Dq 6Dq =e t20 四面体场△三4/9△0 d5,low spin(强场
6Dq 4Dq eg t2ge t2 6Dq 4Dq 八面体场 O=10Dq 四面体场 T= 4/9 O d 5 , High spin(弱场) t2g eg eg t2g d 5 , low spin(强场)
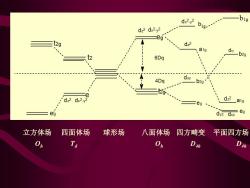
dx2y2 big 01 - dz2 dx2-y2 g eg (2g d22 a1g 6Dq 4Dq dxy b2g d22 dx2. a1g eg ea dyz dxz eg 立方体场 四面体场 球形场 八面体场四方畸变平面四方场 On Ta Dah D4
立方体场 四面体场 球形场 八面体场 四方畸变 平面四方场 Oh Td Oh D4h D4h

部分d4一d7组态ML配合物的电子自旋状态 % M P/cm-1 △,/cm-1 自旋状态 计算 实验 Cr2+ 23,500 H20 13,900 HS HS Mn3+ 28,000 H,O 21,000 HS HS Mn2+ 25,500 H,O 7,800 HS HS Fe3+ 30,000 H,O 13,700 HS HS Fe2+ 17,600 H,O 10,400 HS HS CN- 33,000 LS LS C03+ 21,000 F- 13,000 HS HS NH; 23,000 LS LS C02+ 22,500 H,O 9,300 HS HS
部分d 4-d 7组态ML6配合物的电子自旋状态 d n M P/cm−1 L o /cm−1 自旋状态 计算 实验 d 4 Cr2+ Mn3+ 23,500 28,000 H2O H2O 13,900 21,000 HS HS HS HS d 5 Mn2+ Fe3+ 25,500 30,000 H2O H2O 7,800 13,700 HS HS HS HS d 6 Fe2+ Co3+ 17,600 21,000 H2O CN− F − NH3 10,400 33,000 13,000 23,000 HS LS HS LS HS LS HS LS d 7 Co2+ 22,500 H2O 9,300 HS HS

二.△大小的表征一电子光谱(或电子光谱,紫 外可见光谱 1.单电子的近似的配合物光谱 定性判断: ligand 显色 吸收颜色 0 excitation Cu(NH3)2+ 强场 紫色 黄色 Cu(OH2)42+ 弱场 蓝色 橙色 大小 Cr(NH3)3+ 强场 橙色 蓝色 大 Cr(OH2)63+ 弱场 紫色 黄色 小 ground 只考虑配位场作用,不考虑d电子之间的相互作用 △的能级范围在紫外可见区域,∴.d区元素的配合物有色
二. O大小的表征―电子光谱(或电子光谱,紫 外可见光谱) 1.单电子的近似的配合物光谱 定性判断: ligand 显色 吸收颜色 O excitation Cu(NH3 )4 2+ 强场 紫色 黄色 大 Cu(OH2 )4 2+ 弱场 蓝色 橙色 小 Cr(NH3 )6 3+ 强场 橙色 蓝色 大 Cr(OH2 )6 3+ 弱场 紫色 黄色 小 ground 只考虑配位场作用,不考虑d电子之间的相互作用 O的能级范围在紫外可见区域,d区元素的配合物有色
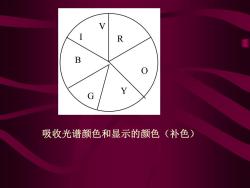
R B 吸收光谱颜色和显示的颜色(补色)
R O Y G B I V 吸收光谱颜色和显示的颜色(补色)

Yellow-green Yellow Green SPECTRAL COLORS Orange-yellow (complement to blue) Green-blue (complement to red) Orange Gray Blue-green Red Blue Red-violet Violet-blue (complement (complement to green) to yellow) Blue-violet
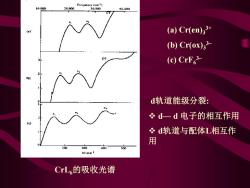
Fiequency icin') 10.040 20.000 10,000 44.000 (a)Cr(en)33+ (b)Cr(ox)33 (c)CrF3 d轨道能级分裂: 必d一d电子的相互作用 51 冬d轨道与配体L相互作 用 200 100 500 kJmol CrL,的吸收光谱
CrL6的吸收光谱 (a) Cr(en)3 3+ (b) Cr(ox)3 3– (c) CrF6 3– d轨道能级分裂: ❖ d— d 电子的相互作用 ❖ d轨道与配体L相互作 用
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第二章 配合物基础和配位立体化学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第一章 酸碱化学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)无机化学课程前言.ppt
- 《无机化学》课程教学资源(参考资料)ds区表格(铜、银、锌、镉、汞)重要化合物.doc
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第八章 d区、ds区元素.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第七章 S区元素.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第六章 配位化合物.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第五章 分子结构和晶体结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第四章 原子结构.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第三章 氧化还原反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第二章 酸碱反应.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)第一章 化学反应一般原理.ppt
- 四川轻化工大学(四川理工学院):《无机化学》课程教学课件(PPT讲稿)分析化学绪论(授课人:丁杰).ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第二十章 s区元素 s-Block Elements.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十九章 金属通论.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十八章 非金属元素小结.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十六章 氮磷砷 Nitrogen, Phosphorus and Arsenic.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十五章 氧族元素 Oxygen family element.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十四章 卤素 Halogen.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十二章 配位平衡 Coordination Equilibrium.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第四章 配合物反应机理和动力学.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第五章 非金属原子簇化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第六章 主族元素的有机金属化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第七章 金属羧基和π酸配体化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第八章 过渡金属有机化合物.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第九章 配位催化反应.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)第十章 金属原子簇和金属多重键.ppt
- 北京大学:《无机化学》课程教学课件(PPT讲稿)无机化学复习总结.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第一章 绪论 Organic Chemistry.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第二章 烷烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第四章 二烯烃和炔烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第五章 脂环烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第八章 立体化学.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第九章 卤代烃.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十章 醇、酚、醚 Alcohol, Phenol and Ether.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十二章 羧酸及其衍生物 Carboxylic acids and derivatives.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十三章 取代羧酸.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十四章 含氮化合物.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十五章 含硫、磷和硅的有机化合物.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十六章 杂环化合物 Heterocyclic compounds.ppt
