《医用化学》课程电子教案(PPT教学课件)第七章 配位化合物

医学化学 第七章配位化合物 第一节配位化合物的基本桡念 第二节配位化合物的价键理论 第三节配位平衡 第四节螯合物 第五节配位化合物在医学上的应用
医学化学 第七章 配位化合物 第一节 配位化合物的基本概念 第二节 配位化合物的价键理论 第三节 配位平衡 第四节 螯合物 第五节 配位化合物在医学上的应用
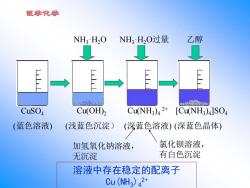
医学化学 NH:H2O NH3HO过量 乙醇 cfatoto p88品o CuSO4 Cu(OH)2 Cu(NH3)42+ [CuNH3)4]S04 (蓝色溶液) (浅蓝色沉淀) (深蓝色溶液)(深蓝色晶体) 加氢氧化钠溶液, 氯化钡溶液, 无沉淀 有白色沉淀 溶液中存在稳定的配离子 Cu(NH3)42+
医学化学 NH3·H2O过量 乙醇 CuSO4 (蓝色溶液) NH3·H2O Cu(NH3 )4 2+ (深蓝色溶液) [Cu(NH3 )4 ]SO4 (深蓝色晶体) Cu(OH)2 (浅蓝色沉淀) 加氢氧化钠溶液, 无沉淀 氯化钡溶液, 有白色沉淀 溶液中存在稳定的配离子 Cu(NH3)4 2+

医学化学 第一节 配合物的基本概念 一、配合物的定义 金属离子(或原子)与一定数目的 中性分子(或阴离子)以配位键方式 结合成的不易离解的复杂离子或复杂 分子称为配离子或配位分子。含有配 离子的化合物或配位分子统称配合物 如:[Cu(NH3)42+、[Ag(CN)2l
医学化学 第一节 配合物的基本概念 一、配合物的定义 金属离子(或原子)与一定数目的 中性分子(或阴离子)以配位键方式 结合成的不易离解的复杂离子或复杂 分子称为配离子或配位分子。含有配 离子的化合物或配位分子统称配合物 。 如: [Cu(NH3 )4 ] 2+ 、 [Ag(CN)2 ]-

医学化学 二、配合物的组成 ■配合物在组成上一般包括内界和外界两 部分。 中心原子(离子或原子) 内界 配合物 配体(单齿或多齿配体) 外界
医学化学 二、配合物的组成 配合物在组成上一般包括内界和外界两 部分。 中心原子(离子或原子) 内界 配合物 配体(单齿或多齿配体) 外界

医学化学 ■现以[Cu(NH)4SO4为例说明配合物 的组成。 内界 I Cu (H))42+ 界 中 配配配 位 位位 原子 原 体数 界离子
医学化学 现以[Cu(NH3 )4 ]SO4为例说明配合物 的组成。 内界 外界 [ Cu (NH3 ) 4 ] 2+ SO4 2- 中 配 配 配 外 心 位 位 位 界 原 原 体 数 离 子 子 子

医学化学 1.内界 在配合物化学式中用方括号表示内界。 ·配合物的内界能稳定地存在于晶体及水 溶液中。它是配合物的特征部分,它的 结构和性质与其他离子不同。 如:[Cu(NH3)4]2+
医学化学 1. 内界 • 在配合物化学式中用方括号表示内界。 • 配合物的内界能稳定地存在于晶体及水 溶液中。它是配合物的特征部分,它的 结构和性质与其他离子不同。 如: [ Cu (NH3 ) 4 ] 2+

医学化学 2.外界 而不在内界的其他离子,如$042·写在 方括号外,构成配合物的外界。 内界与外界之间的结合力是离子键,故 在溶液中内、外界是分离的,分别以离 子状态存在于溶液中。 ·配位分子则没有外界
医学化学 2.外界 • 而不在内界的其他离子,如SO4 2- 写在 方括号外,构成配合物的外界。 • 内界与外界之间的结合力是离子键,故 在溶液中内、外界是分离的,分别以离 子状态存在于溶液中。 • 配位分子则没有外界

3.中心原子 配合物的结构比较复杂,它一般都有一个 ■ 金属离子(原子)作为整个配合物的核心 称作中心原子。 Di 中心原子通常是金属离子或原子,也可是 非金属原子或离子。作为中心离子的基本 条件是核外有空的价层轨道,能接受孤对 电子或离域电子。其中以过渡金属离子居 多,如Fe3+、Cu2+、Co2+、Ag等
3.中心原子 配合物的结构比较复杂,它一般都有一个 金属离子(原子)作为整个配合物的核心 称作中心原子。 中心原子通常是金属离子或原子,也可是 非金属原子或离子。作为中心离子的基本 条件是核外有空的价层轨道,能接受孤对 电子或离域电子。其中以过渡金属离子居 多,如Fe3+ 、Cu2+ 、Co2+ 、Ag+等

医学化学 少数高氧化态的非金属元素也可作中心 离子, 如BF4、Sif,2-中的BI)、Si(V)等。 中心原子如Ni(CO))、[Fe(CO)s]中的Ni、 Fe原子
医学化学 少数高氧化态的非金属元素也可作中心 离子, 如BF4 -、SiF6 2-中的B(Ⅲ)、Si(Ⅳ)等。 中心原子如[Ni(CO)4 )、[Fe(CO)5 ]中的Ni、 Fe原子

医学化学 4.配位体和配位原子 ■在中心离子周围结合着一定数目的 中性分子或阴离子,称配位体。如 [Co(NH)4]2+中的NH3。 配位体中提供孤对电子并与中心离 3 子直接连结的原子(如NH3中的N) 称为配位原子
医学化学 4.配位体和配位原子 在中心离子周围结合着一定数目的 中性分子或阴离子,称配位体。如 [Co(NH3 )4 ] 2+中的NH3。 配位体中提供孤对电子并与中心离 子直接连结的原子(如NH3中的N) 称为配位原子
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《医用化学》课程电子教案(PPT教学课件)第四章 氧化还原反应与电极电势.ppt
- 《医用化学》课程电子教案(PPT教学课件)第三章 酸碱解离平衡和沉淀溶解平衡.ppt
- 《医用化学》课程电子教案(PPT教学课件)第二章 化学反应速率与化学平衡.ppt
- 《医用化学》课程电子教案(PPT教学课件)第一章 溶液和溶胶(主讲:朱焰).ppt
- 《仪器分析实验》课程教学资源(PPT课件)液相色谱——质谱联用仪的使用.ppt
- 天津农学院:紫外可见分光光度计原理及操作(PPT讲稿,主讲:王海凤).ppt
- 《无机化学》课程PPT教学课件(讲稿)第二章 晶体结构与晶体中的缺陷.ppt
- 《无机化学》课程PPT教学课件(讲稿)固体结构.ppt
- 《玉林师专学报(自然科学)》:关于盐酸滴定碳酸钠若干问题的讨论(洛民).pdf
- 《无机化学》课程教学资源(习题)化学反应中的质量关系和能量关系(含参考答案).doc
- 《无机化学》课程教学资源(实验指导)以Fe为原料制备感光液、混合碱分析与测定、胃舒平药片中铝和镁的测定、硫代硫酸钠标定和维生素C片中Vc含量的测定、自来水中氯离子含量的测定.doc
- 《无机化学》课程教学资源(实验指导)以Fe为原料制备感光液、混合碱分析与测定、胃舒平药片中铝和镁的测定、硫代硫酸钠标定和维生素C片中Vc含量的测定、自来水中氯离子含量的测定.doc
- 《无机化学》课程教学资源(参考资料)自来水中余氯量的测定.doc
- 《无机化学》课程教学资源(参考资料)无机化学实验指导书.doc
- 《无机化学》课程教学资源(参考资料)无机化学实验基本仪器和基本操作技术.doc
- 《无机化学》课程教学资源(实验指导)胃舒平药片中铝和镁的测定.doc
- 《无机化学》课程教学资源(实验指导)胃舒平中氢氧化铝的检验.doc
- 《无机化学》课程教学资源(参考资料)无机化学实验模拟试题(一).doc
- 《无机化学》课程教学资源(实验指导)混合碱的分析.doc
- 重庆医科大学:《分析化学》课程教学资源(实验指导)分析化学实验 Analytic Chemistry Experiments.doc
- 《医用化学》课程电子教案(PPT教学课件)第八章 滴定分析法.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十章 烷烃.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十二章 环烃.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十一章 烯烃和炔烃.ppt
- 《医用化学》课程电子教案(PPT教学课件)第五章 原子结构.ppt
- 《医用化学》课程电子教案(PPT教学课件)第六章 化学键和分子结构.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十七章 羧酸及羧酸衍生物.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十三章 对映异构.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十五章 醇酚醚.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十六章 醛酮.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十四章 卤代烃.ppt
- 《医用化学》课程电子教案(PPT教学课件)第二十一章 脂类.ppt
- 《医用化学》课程电子教案(PPT教学课件)第二十二章 氨基酸.ppt
- 《医用化学》课程电子教案(PPT教学课件)第二十章 糖类.ppt
- 《医用化学》课程电子教案(PPT教学课件)第十九章 杂环化合物(aromatic heterocycles).ppt
- 《医用化学》课程电子教案(PPT教学课件)第十八章 有机含氮化合物.ppt
- 山东第一医科大学(泰山医学院):《医学影像检查技术学》课程教学大纲(打印版,负责人:于兹喜).pdf
- 山东第一医科大学(泰山医学院):《医学影像检查技术学》课程实验指导(打印版,共七章).pdf
- 山东第一医科大学(泰山医学院):《生物化学》课程实验指导 Biochemistry Experiment Direction(英文,打印版).pdf
- 山东第一医科大学(泰山医学院):《生物化学》课程各章习题集(打印版,含参考答案).pdf
