山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)分析化学实验教案
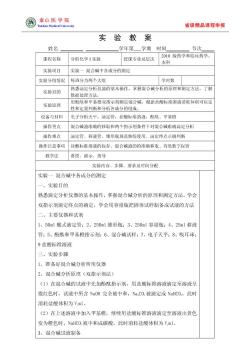
泰山医学院 省级精品课程申报 实 验教案 姓名 学年第学期时间 节次 课程名称 分析化学【实验 授课专业及层次 2010级药学和临药学, 本科 实验项目 实验一混合碱中各成分的测定 实验分组情况每班分为两个大组 学时数 实验目的 熟悉滴定分析仪器的基本作,掌握混合碱分析的原理和测定方法,了解 数据处理方法 实验原理 用酚酞和甲基橙双指示剂测定混合碱,根据盐酸标准溶液消耗体积可以定 性和定量判断和分析各成分的组成。 设备与材料 电子分析天平,滴定管,盐酸标准溶液,酚酞、甲基橙 操作重点 混合碱液准确的移取和两个指示剂条件下对混合碱准确湍定分析 操作难点 滴定管、移液管、锥形瓶规范熟练使用、滴定终点下确判断 操作注意事项 盐酸标准溶液的保存、混合碱液的的准确移取、有效数字保留 教学法 讲授、演示、指导 实验内容、步骤、要求及时间分配 实验一混合碱中各成分的测定 、实验目的 熟悉滴定分析仪器的基本探作,掌握混合碱分析的原理和测定方法,学会 双指示剂滴定终点的确定,学会用容量瓶把固休试样制备成试液的方法 二、主要仪器和试剂 1、50m1酸式滴定管:2、250m1锥形瓶:3、250m1容量瓶:4、25m1移液 管:5、酚酞和甲基橙指示剂:6、混合碱试样:7、电子天平:8、吸耳球: 9盐酸标准溶液 三、实验步骤 1、准备好混合碱分析所用仪器 2、混合碱分析原理(双指示剂法) (1)在混合碱的试液中先加酚酞指示剂,用盐酸标淮溶液滴定至溶液呈 微红色时,试液中所含NaOH完全被中和,Na,CO,被滴定成NaHCO,,此时 消耗盐酸体积为Vml。 (2)在上述溶液中加入甲基橙,继续用盐酸标准溶液滴定至溶液由黄色 变为橙色时,NaHCO,被中和成碳酸,此时消耗盐酸体积为Vml 3、混合碱试液制备
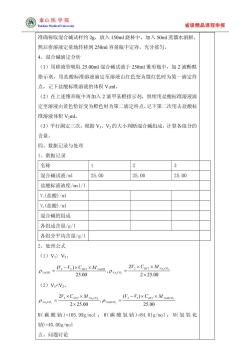
国泰山医学院 dical Univers 省级精品课程申报 准确称取混合碱试样约2g,放入150ml烧杯中,加入50ml蒸馏水溶解, 然后将溶液定量地转移到250ml容量瓶中定容,充分摇匀。 4、混合碱滴定分析 (1)用移液管吸取25.00ml混合碱试液于250ml雏形瓶中,加2滴酚酞 指示剂,用盐酸标准溶液滴定至溶液由红色变为微红色时为第一滴定终 点,记下盐酸标准溶液的体积V1ml。 (2)在上述雏形瓶中再加入2滴甲基橙指示剂,继续用盐酸标准溶液滴 定至溶液由黄色恰好变为橙色时为第二滴定终点,记下第二次用去盐酸标 准溶液体积V2ml。 (3)平行测定三次,根据V1、V2的大小判断混合碱组成,计算各组分的 含量。 四、数据记录与处理 1、数据记录 名称 1 3 混合碱试液/l 25.00 25.00 25.00 盐酸标液浓度/mol/1 Y(盐酸)/m1 V,(盐酸)/ml 混合碱的组成 各组成含量/g/1 各组分平均含量/g/1 2、处理公式 (1)V)V2 V-V:)xCn. 2y,xCg×Mm 25.00 2×25.00 (2)V1<V2. Pxa,co,= 2×25.00 25.00 M(碳酸钠)=105.99g/mol:M(碳酸氢钠)=84.01g/mol:M(氢氧化 )=40.00g/mo1 五、问愿讨论

@泰山医学院 省级精品课程申报 1、用双指示剂法测定混合碱组成的方法原理是什么? 2、采用双指示剂法测定混合碱,试判断下列五种情况下,混合碱的组成? (1)V10,V2)0(2)V)0,V20(3)V〉V2(4)V<V2(5) V1=V2. 六、学生实训
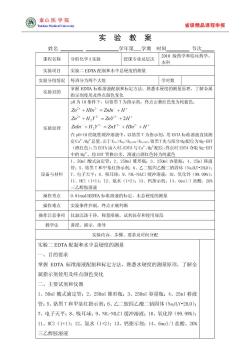
國秦山医学院 省级精品课程申报 实验教案 姓名 学年第学期时间 节次 课程名称 分析化学【实验 授课专业及层次 2010级药学和临味药学, 本科 实验项目 实验二EDTA配制和水中总硬度的测量 实验分组情况 每班分为两个大组 学时数 实验目的 握EDTA标准溶液配制和标定方法,熟悉水硬度的测量原理,了解金属 指示剂使用及终点颜色变化 州为10条件下,以铬黑T为指示剂,终点山紫红色变为纯蓝色。 Zn"HIn'Znln +H' Zn"+HY2-=ZnY2 +2H 实验原理 Znln +H,Y2=ZnY2+HIn2+H' 在pI0的氨性缓冲溶液中,以铬黑T为指示剂,用DTA标准溶液直接测 定Ca,Mg总量.山于Ker>>Km>K,铬黑T先与部分g配位为g-EBT (酒红色).当DTA滴入时,EDTA与C,g2配位,终点时DTA夺取Mg-BT 中的g,将EBT置换出来,溶液山酒红色转为纯蓝色 1、50m1酸式滴定管:2、250ml锥形瓶:3、250ml容量瓶:4,25ml移液 管:5、铬黑T和甲基红指示剂:6、乙二胺四乙酸二钠固体(aY20): 设备与材料 7、电子天半:8、吸耳球;9、NH-NHC1缓冲溶液:10、氧化锌(99.99%): 11、HC1(1+1):12、氨水(1+2):13、钙指示剂:14、6o1/1盐酸、20% 乙醇胺溶液 操作币点 0.O1mol1EDTA标准溶液的标定,水总硬度的测量 操作难点 实验条件控制,终点正确判断 操作注意事项仪器洗涤干净,称量准确,试剂保存和使用规范 教学法讲授、演示、指导 实验内容、步骤、要求及时间分配 实验二EDTA配制和水中总硬度的测量 一、目的要求 掌握EDTA标准溶液配制和标定方法,熟悉水硬度的测量原理,了解金 属指示剂使用及终点颜色变化 二、主要试剂和仪器 1、50ml酸式滴定管:2、250ml雏形瓶:3、250ml容量瓶:4、25ml移液 管:5、铬黑T和甲基红指示剂:6、乙二胺四乙酸二钠固体(NaLY·2L0): 7、电子天平:8、吸耳球:9、NH-NH,C1缓冲溶液:10、氧化锌(99.99%) 11、HC1(1+1):12、氨水(1+2):13、钙指示剂:14、6mol/1盐酸、20% 三乙醇胺溶液

泰山医学院 省级精品课程申报 三、实验步骤 1、准备好酸式滴定管和相关的分析仪器并洗涮干净 2、0.01mo/EDTA标准溶液的配制 称取EDTA二钠盐(分析纯)1.9g于250ml烧杯中,加蒸馏水150ml 加热溶解,必要时过滤。冷却后用蒸馏水稀释至500ml,摇匀,保存在红 口瓶中。 3、NH-NH,C1缓冲溶液(p10)配制:称取氯化铵周体154g加蒸馏水溶 解,加相对密度为0.9的浓氨水380ml,再加蒸馏水稀释至1L 4、氧化锌基准溶液的配制 准确称取经110℃烘干至恒重的基准物氧化锌约0.20-0.22g,加入3ml 稀盐酸使之溶解。将此溶液全部转移至250m1容量瓶中,用水冲洗烧杯壁 几次,洗液一并转移到容量瓶中,用水稀释至刻度摇匀。 5、标准溶液的标定 (1)用移液管移取基准溶液25.00ml于锥形瓶中,加1滴甲基红,用 胶头滴管吸取稀氨水滴加基准溶液有红色变微黄色溶液时即可。 (2)在上述溶液中加20ml蒸馏水、10ml缓冲溶液和3滴铬黑T指示 剂,用配制的EDTA滴定至溶波由酒红色变为纯蓝色即为终点,记录消耗 EDTA溶液的体积。平行测定3次。 6、水的总硬度的测定 用移液管移取50.00ml自来水于250ml锥形瓶中,加入1-2滴盐酸使试 液酸化,煮沸数15分钟以除去二氧化碳。冷却后加入3ml三乙醇胺,10ml 氨性缓冲溶液(pH=10),1mlNa2S溶液掩赦重金属离子,最后再加入3 滴EBT指示剂,立即用EDTA标准溶液滴定,当溶液刚好由酒红色变为 纯蓝色(蓝紫色)即为终点,记录EDTA消耗的体积VI。平行测定三份。 计算水的总硬度(钙、镁总含量)。 四、数据记录和处理 (1)数据记录 1、EDTA数据记录 名称 1 2 3 氧化锌基准溶液体积/ml 25.0025.0025.00 氧化锌基准溶液浓度/mol/1

@泰山医学院 省级精品课程申报 EDTA溶液体积/ml EDTA溶液浓度mol/1 EDTA溶液平均浓度/mol/1 相对平均偏差 2、处理公式C mo×10x100 ,M(氧化锌)=81.38g/mol: VEDTA X MZo 3、水总硬度数据记录 名称 123 水样的体积/l 50.0050.0050.00 EDTA溶液浓度mol/1 水的总硬度(氧化钙)/g/1 水的平均总硬度(氧化钙)/g/ 钙和镁平均硬度/mg/ Ca 水总硬度的相对平均偏差 总硬度(氧化钙mg1L)=(CVTA×M@x1O00 五、问题讨论 1、为什么要用胶头滴管滴加稀氨水? 2、标定中为什么要加缓冲溶液?没缓冲溶液存在,将导致什么现象发生? 3、为什么滴定钙镁总量时要控制p为10? 六、学生实训
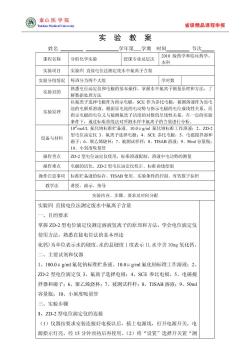
泰山医学院 省级精品课程申报 实 验 教案 姓名 学年第学期时间」 节次 课程名称 分析化学实验 授课专业及层次 2010级药学和临怵药学 本科 实验项目 实验四直接电位法测定废水中氟离子含量 实验分组情况每班分为两个大组 学时数 实验目的 熟悉电位滴定仪和电极的基本燥作,掌握水中氟离子测量原理和方法, 解数据处理方法 以氯离子选样电极作为指示电极,SCE作为参比电极,被测溶液作为原电 实验原理 池的电解质溶液,根据原电池的电动势与指示电极的电位成线性关系,而 指示电极的电位又与被测氟离子活度的对数值呈线性关系,在一定的实验 条件下,通过标准曲线法对所测水样中氟离子的含量进行分析。 10mo1L氟化钠标准贮备液、10.0μgml氟化钠标准工作溶液:2,ZD- 设备与材料 型电位滴定仪3、氟离子选样电极:4、SCE参比电极,5、电磁搅拌器和 磁子:6、聚乙烯烧杯:7、被测试样样:8、TISAB溶液:9、S0ml容量瓶: 10、小刻度吸量管 操作重点 ZD-2型电位滴定仪使用,标准溶液配制,溶液中电动势的测量 操作难点 电极的活化、ZD-2型电位滴定仪校正、标准曲线绘制 操作注意事项标准贮备液的保存、TISAB使用、实验条件的控制、有效致字保刷 教学法 讲授、演示、指导 实验内容、步骤、要求及时间分配 实验四直接电位法测定废水中氟离子含量 一、目的要求 掌握ZD-2型电位滴定仪测定溶液氢离子的原理和方法,学会电位滴定仪 使用方法,熟悉直接电位法的基本理论 化钙)为单位表示水的硬度。水的总硬度1度表示1L水中含10mg氧化钙 二、主要试剂和仪器 1、100.0μgml氟化钠标准贮备液、10.0μgml氟化钠标准工作溶液:2、 ZD-2型电位滴定仪3、氟离子选择电极:4、SCE参比电极,5、电磁搅 拌器和磁子;6、聚乙烯烧杯:7、被测试样样:8、TISAB溶液:9、50ml 容量瓶:10、小刻度吸量管 三、实验步骤 1、ZD-2型电位滴定仪的连接 (1)仪器按要求安装连接好电极以后,插上电源线,打开电源开关,电 源指示灯亮。经15分钟预热后再使用。(2)将“设置”选择开关置“测

@,泰山医学院 省级精品课程申报 量”,“pH/mv”选择开关置“mv”。 (3)调节“温度”旋钮,使旋钮白线指向对应的溶液温度值。 2、清洗电极 取去离子水50ml-60ml至100ml烧杯中,放入搅拌磁子,插入氟离子电 极和饱和甘汞电极。开启搅拌器,2-3min后,若读数大于-200mV,则更 换去离子水,继续清洗,直至读数小于-260mV(或大于260mV)。 3、氟离子标注溶液的配制和测定 用吸量管分别吸取1.00、3.00、5.00、10.00、20.00ml氟化钠标准工作溶 液(10.0μgml)置于5个50ml容量瓶中,在每一个容量瓶中加入 10 mlTISAB溶液,用去离子水稀释至标线,摇匀。分别注入100ml聚乙 烯杯中,放入一只塑料搅拌棒,以浓度由低到高为顺序,分别依次插入氟 离子和参比电极,连续搅拌溶液,待ZD-2型电位计显示的数值稳定后。 读取电动势E值,并列表记录。在每一次测量之前都要用滤纸吸干或待 测液冲洗电极表面、聚乙烯杯和搅拌棒后再进行另一溶液的测量。 4、待测试样的测定 用吸量管吸取25.00ml试样溶液置于50ml容量瓶中,用醋酸钠或盐酸调 至今中性,加入10 nlTISAB溶液,用去离子水稀释至标线,摇匀。将其 注入100ml聚乙烯杯中,放入一只塑料搅拌棒,插入电极,连续搅拌溶 液,待ZD2型电位计显示的数值稳定后,读取电动势E、值。 四、数据记录和处理 (1)数据记录 F/mol/L 试样溶液 E/mv (2)校准曲线绘制 根据测定所得的电动势值Es,在半对数坐标纸上绘制E(mV)lgC:(mg) 校准曲线,浓度标示在对数分格上,最低浓度标示在横坐标的起点线上 (3)贴坐标纸处(靠左对齐贴) (4)水样中氟含量的确定 根据测定试样的E值,从校准曲线上查得相应的以mg1表示的氟离子含 量。并按公式C#手=查得值×2,计算试样氟离子含量。 试样氟离子含量

泰山医学院 省级精品课程申报 五、问题讨论 1、参比电极和指示电极的作用是什么? 2、氟离子选择电极在使用时应注意哪些问题? 3、总离子强度调节缓冲溶液(TISAB)如何配制?在测量中起哪些作用? 六、学生实训
④秦山医学院 n Medical Universit 省级精品课程申报 实验教案 姓名 学年第学期时间 节次 课程名称 分析化学实验 授课专业及层次 2010级药学和临床药学 本科 实验项目 实验五UNs分光光度法测定全铁的合 实验分组情况 每班分为两个大组 学时数 实验目的 熟悉紫外可见光度计的基本操作,掌握溶液中铁离子测量原理和方法,了 解数据处理方法 以盐酸羟胶做还原剂使水中三价铁还原成二价铁,用邻二氮非做显色剂便 实验原理 其与二价铁反应生成邻二氯非亚铁配合物,通过测量显色配合物的含量即 可求得被测水样中二价铁的含最,在一定的实验条件下,通过标准曲线法 对所测水样中全铁的含量进行分析 1、10molL铁标准贮备液:2、100g1盐酸羟胺水溶液:3、邻二氮菲水溶 设备与材料 液:4、紫外可见分光光度计:5、被测试样溶液:6、吸收池:7、擦镜纸: 8、50ml容量瓶(7个):9、小刻度吸量管 操作重点 紫外可见分光光度计使用,标准溶液配制,溶液中吸光度的测量 操作难点紫外可见分光光度计的校正、标准溶液配制、标准曲线绘制 操作注意事项标准贮备液的保存、各种试剂的用量、实验条件的控制、有效数字保 教学法 讲授、演示、指导 实验内容、步骤、要求及时间分配 实验五UV-VIS分光光度法测定全铁的含量 一、目的要求 掌握分光光度法测定全铁的原理和方法,学会分光光度计使用方法,熟悉 分光光度法的基本理论。 二、主要试剂和仪器 1、10moL铁标准贮备液:2、100g1盐酸羟胺水溶液:3、邻二氮菲水 溶液:4、分光光度计:5、被测试样溶液:6、吸收池:7、擦镜纸:8、 50ml容量瓶(7个):9、小刻度吸量管 三、操作步骤 1、UV-2000型分光光度计基本操作无论选用何种测量方式,都必须遵循 以下基本操作 (1)连接仪器电源线,确保仪器供电电源有良好的接地性能。(2)接通 电源,使仪器预热20分钟(不包括仪器自检时间)。(3)用键 设置测试方式:透射比(T),败光度(A),已知标准样品浓度值方式(C)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第十九章 平面色谱法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第十八章 高效液相色谱法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第十七章 气相色谱法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第十六章 色谱分析法概论.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第十五章 质谱法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第十四章 核磁共振波谱法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第十三章 原子吸收光度法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第十二章 红外吸收光谱法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第十一章 分子荧光分析法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第十章 紫外可见吸收分光光度法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第九章 光谱分析法概论.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第八章 电位分析法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第七章 沉淀滴定分析法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第六章 氧化还原滴定分析法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第五章 配位滴定分析法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第四章 酸碱滴定分析法.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第三章 滴定分析法概论.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第二章 误差和分析数据处理.pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程授课教案(打印版)第一章 绪论(负责人:李志富).pdf
- 山东第一医科大学(山东省医学科学院):《分析化学》课程教学资源(复习资料)分析化学总复习内容.doc
- 山东第一医科大学(山东省医学科学院):《物理化学》课程大纲教案(打印版)实验教学大纲.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程大纲教案(打印版)理论教学大纲(负责人:毕玉水).pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程试卷习题(打印版)课程试卷(试题).pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程试卷习题(打印版)课程试卷(答案).pdf
- 《物理化学》课程教学资源(学习资料)物理化学知识点框架结构.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程习题解答(打印版)01-热力学第一定律.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程习题解答(打印版)02-热力学第二定律.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程习题解答(打印版)03-多组分系统热力学及在溶液中应用.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程习题解答(打印版)04-化学平衡.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程习题解答(打印版)05-相平衡.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程习题解答(打印版)06-电化学.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程习题解答(打印版)07-化学动力学.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程习题解答(打印版)08-表面物理化学.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程习题解答(打印版)09-胶体分散系统.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程习题解答(打印版)10-大分子溶液.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程教案讲义(打印版)物理化学实验指导.pdf
- 山东第一医科大学(山东省医学科学院):《物理化学》课程教案讲义(打印版)物理化学授课教案.pdf
- 西北农林科技大学:《有机化学》课程教学大纲及日历(双语)Organic Chemistry.pdf
- 《有机化学》课程教学资源(参考书籍)Organic chemistry with biological applications, 3ed-Gengage Learning, John E. McMurry, Brooks Cole(2015).pdf
- 《有机化学》课程教学资源(参考书籍)Organic Chemistry, 8th ed 2017, Paula Yurkanis Bruice, University Of California Santa Barbara.pdf
