《水文地质学基础》课程授课教案(讲稿)第六章 地下水的化学成分及其形成作用

课程名称:水文地质学基础第周第7讲次第六章地下水的化学成分及其形成作用S1概述授课题目(章、节)s2地下水的化学特征一—一地下水的化学成分S3地下水化学成分的形成作用S4地下水化学成分的分析、表示、地下水化学分类本讲目的及重点:【目的要求]:通过本章学习,使学生认识地下水的主要化学成分,了解地下水化学成分的形成作用。通过节学习,使掌握地下水化学成分分析的内容、数据的处理,化学表达式及化学成分分类。[重点]:地下水的主要化学成分,地下水化学形成作用,库尔洛夫式及舒卡列夫分类[难点]:利用地下水化学作用分析水质随时空变化特征,数据的处理,库尔洛夫式备注内容[本讲内容的引入]:,地下水是一种复杂的天然溶液,一个地区地下水的化学面貌,反映了该地区地下水的历史演变,地下水的某些特殊化学组分,可以作为宝贵的液体矿床或可以作为找矿标志,地下水利用时,更是需要水质检查。研究地下水中化学元素迁移、集聚与分散的规律一一水文地球化学与研究地下水水量变化的一一地下水动力学共同构成水文地质学的理论基础。“第六章地下水的化学成分及其形成作用”S1概述1.地下水是一种复杂的天然溶液与岩土发生化学反应与大气圈、地表水圈、生物圈进行水量交换受人类活动的影响问:地下水的水质与其迁移的途径的关系?2.为什么要研究地下水的化学成分及其形成作用(1)一个地区地下水的化学面貌,反映了该地区地下水的历史演变。研究地下水的化学成分,可以帮助我们回溯一个地区的水文地质历史,阐明地下水的起源与形成。(2)大量盐类或富集某些稀有元素的地下水是宝贵的液体矿床,比如盐井,某些具有特殊物理性质与化学成分的水具有医疗意义。(3)地下水围绕盐矿、油田及金属矿床,往往形成特定化学元素的分散晕圈是找矿标志。也可以用于污染源确定
课程名称:水文地质学基础 第 周 第 7 讲次 授课题目(章、节) 第六章 地下水的化学成分及其形成作用 §1 概述 §2 地下水的化学特征——地下水的化学成分 §3 地下水化学成分的形成作用 §4 地下水化学成分的分析、表示、地下水化学分类 本讲目的及重点: [目的要求]:通过本章学习,使学生认识地下水的主要化学成分,了解地下水化学成分的形成作用。通过 节学习,使掌握地下水化学成分分析的内容、数据的处理,化学表达式及化学成分分类。 [重点]: 地下水的主要化学成分,地下水化学形成作用,库尔洛夫式及舒卡列夫分类 [难点]:利用地下水化学作用分析水质随时空变化特征 ,数据的处理,库尔洛夫式 内 容 备 注 [本讲内容的引入]:.地下水是一种复杂的天然溶液,一个地区地下水的化学面貌,反映了该 地区地下水的历史演变,地下水的某些特殊化学组分,可以作为宝贵的液体矿床或可以作为 找矿标志,地下水利用时,更是需要水质检查。研究地下水中化学元素迁移、集聚与分散的 规律——水文地球化学 与研究地下水水量变化的——地下水动力学共同构成水文地质学的理论基础。“第六章 地 下水的化学成分及其形成作用” §1 概述 1.地下水是一种复杂的天然溶液. 与岩土发生化学反应 与大气圈、地表水圈、生物圈进行水量交换 受人类活动的影响 问:地下水的水质与其迁移的途径的关系? 2. 为什么要研究地下水的化学成分及其形成作用 (1)一个地区地下水的化学面貌,反映了该地区地下水的历史演变。研究地下水的化学成 分,可以帮助我们回溯一个地区的水文地质历史,阐明地下水的起源与形成。 (2)大量盐类或富集某些稀有元素的地下水是宝贵的液体矿床,比如盐井,某些具有特殊物 理性质与化学成分的水具有医疗意义。 (3)地下水围绕盐矿、油田及金属矿床,往往形成特定化学元素的分散晕圈是找矿标志。 也可以用于污染源确定

(4)地下水的利用,往往需要水质评价。水文地质学的理论基础:研究地下水中化学元素迁移、集聚与分散的规律一一水文地球化学研究地下水水量变化的一一地下水动力学2地下水的化学特征一一地下水的化学成分1.主要的气体成分气体在地下水中含量不高,其意义在于:反映地下水所处的地球化学环境;有些气体将增加水溶解盐类的能力,促进某些化学反应。(1)氧(O2)与氮(N2)主要来源于大气,随同大气降水及地表水补给地下水,所以与大气圈关系密切的地下水中含氧(O2)与氮(N2)较多。(O2)较活泼,易发生氧化作用而消耗。氮(N2)的单独存在,说明地下水起源于大气并处于封闭的还原环境。大气中4+K+X=0.0118,如地下水的气体的比值等于此值,N2说明氮(N2)起源于大气,小于此,表明水中含有生物起源或变质起源的氮(N2)。(2)二氧化碳(CO2)降水、地表水补给少;主要来源于表生带的生物化学作用和地壳深部变质作用与火山作用。浅部地下水,(CO2)主要来源于大气及土壤层中生物化学作用;深部含碳酸盐岩石的变质能分解出(CO2);CaCO,—400C→CaO+CO,;上地慢易挥发馏分中的(CO2)可沿岩石圈深大断裂上升外逸,在地球表面形成(CO2)气体集中出露带,这种(CO2)集中出露带的分布往往同世界上的火山带及地震带相一致。(CO2)含量越多,岩溶作用越强,对结晶岩类的风化作用能力越强。(3)硫化氢(H2S)与甲烷(CH)CH,+CaSO→CaCO,+H,S+H,O硫化氢(H2S)可以由生物化学作用形成,如RSO4+2C+2H,O→R(HCO,)2 +H,S也可以由变质作用及火山作用形成。硫化氢(H2S)是化学性质活泼,溶解度最大的气体,又是区分氧化与还原环境的重要标志(氧化环境的水中无硫化氢(H2S),还原环境的水中硫化氢(H2S)含量大于7mg/L。)甲烷(CH4)化学性质不活泼,理藏在封闭沉积盆地中的地下水常含有大量甲烷(CH4)
(4)地下水的利用,往往需要水质评价。 水文地质学的理论基础: 研究地下水中化学元素迁移、集聚与分散的规律——水文地球化学 研究地下水水量变化的——地下水动力学 §2 地下水的化学特征——地下水的化学成分 1.主要的气体成分 气体在地下水中含量不高,其意义在于:反映地下水所处的地球化学环境;有些气体 将增加水溶解盐类的能力,促进某些化学反应。 (1) 氧(O2)与氮(N2), 主要来源于大气,随同大气降水及地表水补给地下水,所以与大气圈关系密切的地下水 中含氧(O2)与氮(N2)较多。 (O2)较活泼,易发生氧化作用而消耗。氮(N2)的单独存在,说明地下水起源于大气 并处于封闭的还原环境。大气中 0.0118 2 = + + N Ar Kr Xe ,如地下水的气体的比值等于此值, 说明氮(N2)起源于大气,小于此,表明水中含有生物起源或变质起源的氮(N2)。 (2)二氧化碳(CO2) 降水、地表水补给少; 主要来源于表生带的生物化学作用和地壳深部变质作用与火山作用。 浅部地下水,(CO2)主要来源于大气及土壤层中生物化学作用;深部含碳酸盐岩石的变 质能分解出(CO2); 2 400 CaCO3 CaO CO C ⎯⎯⎯→ + ;上地幔易挥发馏分中的(CO2)可沿岩 石圈深大断裂上升外逸,在地球表面形成(CO2)气体集中出露带,这种(CO2)集中出露 带的分布往往同世界上的火山带及地震带相一致。(CO2)含量越多,岩溶作用越强,对结晶 岩类的风化作用能力越强。 (3)硫化氢(H2S)与甲烷(CH4) 硫化氢(H2S)可以由生物化学作用形成,如 RSO C H O R HCO H S CH CaSO CaCO H S H O 4 2 3 2 2 4 4 3 2 2 + 2 + 2 → ( ) + + → + + ; 也可以由变质作用及火山作用形成。 硫化氢(H2S)是化学性质活泼,溶解度最大的气体,又是区分氧化与还原环境的重要 标志(氧化环境的水中无硫化氢(H2S),还原环境的水中硫化氢(H2S)含量大于 7mg/L。) 甲烷(CH4)化学性质不活泼,埋藏在封闭沉积盆地中的地下水常含有大量甲烷(CH4)

由有机物分解生成,常与油田伴生。也是还原地球化学环境的标志。2、主要的离子成分七种主要离子:氯离子(CI),硫酸根离子:(SO42-)重碳酸根离子(HCO3-),钠离子(Na)钾(K+)钙(Ca2+)镁(Mg2+)。为什么这此些离子在地下水中含量较高,条件:构成这些离子的元素在地壳中含量较高,且较易溶于水(如O2、Ca、Mg、Na、K):地壳中含量不大,但极易溶于水(如CI、以SO42形式出现的S),反之Si,Al,Fe虽然在地壳中含量很大,但难溶于水,含量不大。不同盐类在水中的溶解度不同,总矿化度变化时,主要离子成分不同。氯离子(CI):(1)沉积岩溶解;(2)岩浆岩中矿物的风化溶解;(3)海水:(4)火山喷发的溶滤:(5)人为污染特点:是水中最稳定的离子,(不为植物及细菌摄取、不为土粒表面吸附、其氯盐溶解度大,不易沉淀析出随矿化度增加而增加,其含量可以用来说明地下水的矿化程度。硫酸根离子(SO4-):(1)沉积岩溶解,如石膏:(2)硫化物氧化,如黄铁矿、金属硫化物矿床;(3)“酸雨”地表水补给特点:中等矿化度水中常为主要离子,重碳酸根离子(HCO3-):(1)沉积岩与变质岩的溶解,如石灰岩、大理岩(CO2)的作用。(2)岩浆岩、变质岩区,铝硅酸盐矿物的风化溶解。特点:低矿化度水中常为主要离子钠离子(Nat):(1)沉积岩的溶解:(2)海水:(3)岩浆岩、变质岩区含钠矿物的风化溶解。如钠长石特点:低矿化度水中含量少,高矿化度水中含量多钾(K+):来源类似于钠特点:来源类似于钠,含量少,将其归并至钠分析。参与形成不溶于水的次生矿物,为植物摄取。钙(Ca2+):(1)沉积岩的溶解;(2)岩浆岩、变质岩区含钠矿物的风化溶解。特点:低矿化度水中主要离子,矿化格外高,也可成为主要离子镁(Mg2+):来源及分布均于钙(Ca2+)类似。特点:低矿化水中含少量,通常不成为主要离子。3、其它成分其它离子:
由有机物分解生成,常与油田伴生。也是还原地球化学环境的标志。 2、主要的离子成分 七种主要离子:氯离子(Cl-),硫酸根离子 (SO42-) 重碳酸根离子(HCO3-),钠离子(Na+) 钾(K+) 钙(Ca2+) 镁(Mg2+) 。 为什么这此些离子在地下水中含量较高,条件:构成这些离子的元素在地壳中含量较高, 且较易溶于水(如 O2、Ca、Mg、Na、K);地壳中含量不大,但极易溶于水(如 Cl、以 SO4 2- 形式出现的 S),反之 Si,Al,Fe 虽然在地壳中含量很大,但难溶于水,含量不大。 不同盐类在水中的溶解度不同,总矿化度变化时,主要离子成分不同。 氯离子(Cl-):(1)沉积岩溶解;(2)岩浆岩中矿物的风化溶解;(3)海水;(4)火山喷发 的溶滤;(5)人为污染 特点:是水中最稳定的离子,(不为植物及细菌摄取、不为土粒表面吸附、其氯盐溶解 度大,不易沉淀析出) 随矿化度增加而增加,其含量可以用来说明地下水的矿化程度。 硫酸根离子(SO42-):(1)沉积岩溶解,如石膏;(2)硫化物氧化,如黄铁矿、金属硫化物 矿床;(3)“酸雨”地表水补给 特点:中等矿化度水中常为主要离子, 重碳酸根离子(HCO3-):(1)沉积岩与变质岩的溶解,如石灰岩、大理岩(CO2)的作用。 (2)岩浆岩、变质岩区,铝硅酸盐矿物的风化溶解。 特点:低矿化度水中常为主要离子 钠离子(Na+):(1)沉积岩的溶解;(2)海水;(3)岩浆岩、变质岩区含钠矿物的风化溶解。 如钠长石 特点:低矿化度水中含量少,高矿化度水中含量多 钾(K+):来源类似于钠 特点:来源类似于钠,含量少,将其归并至钠分析。参与形成不溶于水的次生矿物,为植物 摄取。 钙(Ca2+):(1)沉积岩的溶解;(2)岩浆岩、变质岩区含钠矿物的风化溶解。 特点:低矿化度水中主要离子,矿化格外高,也可成为主要离子 镁(Mg2+):来源及分布均于钙(Ca2+)类似。 特点:低矿化水中含少量,通常不成为主要离子。 3、其它成分 其它离子:

微量元素:化合物胶体:有机质:微生物,如硫细菌、铁细菌,4、地下水的总矿化度及化学成分表示式总矿化度:地下水中所含各种离子、分子与化合物的总量。表征:105-110时将水蒸干所得的干残余物总量;化学分析,得阴阳离子含量相加,求得理论干残余物值((HCO3-)只能取半数)单位:g/L化学成分表示式:库尔洛夫式阴阳离子分别标示在横线上下,按毫克当量百分数自大而小排列,小于10%不表示;横线前依次:气体成分、特征成分、矿化度(M),t代表水温。33地下水化学成分的形成作用地下水主要来源于大气降雨,矿化度一般为0.02-0.05g/1、溶滤作用:定义:与岩王相作用,岩土中的一部分物质转入地下水中。其结果使岩土失去一部分可溶物质,地下水则补充了新的组分。机理:水溶液对矿物盐类的溶解,是取决于其溶解度:溶解作用与结晶作用溶滤作用强度的影响因素:(1)组成岩土的矿物盐类的溶解度;(2)岩土的空隙性;(3))水的溶解力:低矿化度水溶解能力强,高矿化度水溶解能力弱。水中气体的含量决定某些盐类的溶解能力(4)地下水的径流与交替强度是决定溶滤作用强度的最活跃、最关键因素。特点:区别于简单溶解,是一种与一定的自然地理与地质环境相联系的历史过程。一个地区经受溶滤愈强烈,时间愈长,地下水的矿化度愈低。问题:径流与交替强度对地下水质(矿化度)影响?2、浓缩作用:地下水溶液浓缩,矿化度不断增大汇区的蒸发排泄,使地下水成为以(CI)(Na*)为主要成分的高矿化水。条件:3、脱碳酸作用:CO2的溶解度随温度升高或压力降低减小,从而使(Ca2+)、镁(Mg2+)(HCO3-)
微量元素: 化合物胶体: 有机质: 微生物,如硫细菌、铁细菌, 4、地下水的总矿化度及化学成分表示式 总矿化度:地下水中所含各种离子、分子与化合物的总量。 表征: 105-110 时将水蒸干所得的干涸残余物总量; 化学分析,得阴阳离子含量相加,求得理论干涸残余物值((HCO3-)只能取半数) 单位:g/L 化学成分表示式:库尔洛夫式 阴阳离子分别标示在横线上下,按毫克当量百分数自大而小排列,小于 10%不表示; 横线前依次:气体成分、特征成分、矿化度(M),t 代表水温。 §3 地下水化学成分的形成作用 地下水主要来源于大气降雨,矿化度一般为 0.02-0.05g/l 1、溶滤作用: 定义:与岩土相作用,岩土中的一部分物质转入地下水中。其结果使岩土失去一部分可溶物 质,地下水则补充了新的组分。 机理:水溶液对矿物盐类的溶解,是取决于其溶解度:溶解作用与结晶作用 溶滤作用强度的影响因素: (1) 组成岩土的矿物盐类的溶解度; (2) 岩土的空隙性; (3) 水的溶解力:低矿化度水溶解能力强,高矿化度水溶解能力弱。 水中气体的含量决定某些盐类的溶解能力 (4) 地下水的径流与交替强度是决定溶滤作用强度的最活跃、最关键因素。 特点:区别于简单溶解,是一种与一定的自然地理与地质环境相联系的历史过程。一个地区 经受溶滤愈强烈,时间愈长,地下水的矿化度愈低。 问题:径流与交替强度对地下水质(矿化度)影响? 2、浓缩作用:地下水溶液浓缩,矿化度不断增大 汇区的蒸发排泄,使地下水成为以(Cl-)(Na+)为主要成分的高矿化水。 条件: 3、脱碳酸作用:CO2 的溶解度随温度升高或压力降低减小,从而使(Ca2+)、镁(Mg2+)、(HCO3-)

减少。4、脱硫酸作用:脱硫酸细菌、封闭地质构造5、阳离子交替吸附作用:岩土颗粒表面带有负电荷,吸附阳离子,一定条件下,颗粒将吸附地下水中某些阳离子,而将其原来吸附的部分阳离子转为地下水中的组分。阳离子吸附能力大小排序:(1)排在后面的可以被排在前面的置换,然后进入地下水。(2)地下水中相对浓度增大,吸附能力增大,(Nat)可以置换(Ca2+)(3)粘土、粘土岩类易发生交替吸附作用6、混合作用:成分不同的两种水汇合,形成化学成分与原来两者不同的地下水。7、人类活动在地下水化学成分形成中的作用废弃物对地下水污染;改变地下水形成条件:海水入侵、咸水运移使淡水变咸;地表水灌溉,浅层地下水变咸;改变径流,使咸水变淡;S4地下水化学成分的分析、表示与分类1、地下水化学分析内容一般水文地质调查中,分为:简分析、全分析、专项分析简分析:了解区域地下水的概貌;野外利用专门的水质分析箱进行;分析项目:(1)物理性质包括:温度、颜色、透明度、嗅(气味)、味(口味)。(2)定量分析:重碳酸根离子(HCO3-)、硫酸根离子(SO42-),氯离子(CI),钙(Ca2+);总硬度、PH值;求各主要离子的含量及总矿化度。(3)定性分析:NO3、NO2-、NH4-、Fe2+、Fe3+、H2S、耗氧量,了解水质是否适于饮用。全分析:简分析基础上选取代表性水样,较全面了解地下水化学成分,对简分析检验。结果:将离子以mg/l表示2、分析数据处理及结果表达地下水化学成分的分析结果通常是用毫克/升(mg/1)作单位来表示,在资料整理过程中的要求是●用毫克当量/升(meq/1)和毫克当量百分数(meq%)来表示水分析结果:·计算分析误差,用百分数表示·计算水的各种硬度;写出库尔洛夫式,并按表示式确定水的类型。?
减少。 4、脱硫酸作用:脱硫酸细菌、封闭地质构造 5、阳离子交替吸附作用:岩土颗粒表面带有负电荷,吸附阳离子,一定条件下,颗粒将吸 附地下水中某些阳离子,而将其原来吸附的部分阳离子转为地下水中的组分。 阳离子吸附能力大小排序: (1) 排在后面的可以被排在前面的置换,然后进入地下水。 (2) 地下水中相对浓度增大,吸附能力增大,(Na+)可以置换(Ca2+) (3) 粘土、粘土岩类易发生交替吸附作用 6、混合作用:成分不同的两种水汇合,形成化学成分与原来两者不同的地下水。 7、人类活动在地下水化学成分形成中的作用 废弃物对地下水污染; 改变地下水形成条件:海水入侵、咸水运移使淡水变咸;地表水灌溉,浅层地下水变咸;改 变径流,使咸水变淡; §4 地下水化学成分的分析、表示与分类 1、 地下水化学分析内容 一般水文地质调查中,分为:简分析、全分析、专项分析 简分析:了解区域地下水的概貌;野外利用专门的水质分析箱进行; 分析项目: (1) 物理性质包括:温度、颜色、透明度、嗅(气味)、味(口味)。 (2) 定量分析:重碳酸根离子(HCO3-)、硫酸根离子 (SO42-),氯离子(Cl-),钙(Ca2+); 总硬度、PH 值;求各主要离子的含量及总矿化度。 (3) 定性分析:NO3-、NO2-、NH4-、Fe2+、Fe3+、H2S、耗氧量,了解水质是否适于饮用。 全分析:简分析基础上选 取代表性水样,较全面了解地下水化学成分,对简分析检验。 结果:将离子以 mg/l 表示 2、分析数据处理及结果表达 地下水化学成分的分析结果通常是用毫克/升(mg/1)作单位来表示,在资料整理过程 中的要求是; ⚫ 用毫克当量/升(meq/1)和毫克当量百分数(meq%)来表示水分析结果: ⚫ 计算分析误差,用百分数表示; ⚫ 计算水的各种硬度; ⚫ 写出库尔洛夫式,并按表示式确定水的类型

(1)毫克/升换算为毫克当量/升及毫克当量百分数计算公式:毫克当量/升=(毫克/升)/当量例:Ca2+为557.49mg/L,换算为557.49/20.04=27.82meq/L,20.04为Ca2+的当量。毫克当量百分数(阴阳离子毫克当量总数各作为100%来计)的计算:(1)换算毫克升(mg/1)为毫克当量/升(meq/1)及毫克当量百分数离子的毫克当量数=离子的毫克数离子的当量(2)计算分析误差:分析误差用下式计算:Zk一一阳离子总含量,meq/L;Za一一阴离子总合量,meq/L。Zk-Zα×100%e=k+Ma按要求,全分析时允许分析误差不超过2%,简分析不超过5%。(3)计算水的各种硬度水的总硬度计算:H=[Ca2+]+[Mg2+] ,meq/L暂时硬度计算计算水的暂时硬度时,需要考虑Ca2+和Mg2+的毫克当量总数与HCO毫克当量之间的两种可能关系:①、如[Ca2++Mg2+]≤[HCO:]】(meq/L),则暂时硬度即等于总硬度。因为它不可能大于总硬度:②、当[Ca2++Mg2+]>[HCO:]时,则水的暂时硬度小于总硬度,并等于的HCO的含量(meq/L)。永久硬度:总硬度-暂时硬度=37.302.90=34.40meq/L。(4)用库尔洛夫式表示水分析结果,并根据库尔洛夫表示式确定水的类型
(1)毫克/升换算为毫克当量/升及毫克当量百分数 计算公式 : 毫克当量/升=(毫克/升)/当量 例: Ca 2+为 557.49 mg/L,换算为 557.49/20.04=27.82meq/L,20.04 为 Ca 2+ 的当量。 毫克当量百分数(阴阳离子毫克当量总数各作为 100%来计)的计算:(1)换算毫克/ 升(mg/l)为毫克当量/升(meq/l)及毫克当量百分数 离子的当量 离子的毫克数 离子的毫克当量数 = (2)计算分析误差: 分析误差用下式计算: Σk——阳离子总含量,meq/L; Σa——阴离子总合量, meq/L。 按要求,全分析时允许分析误差不超过 2%,简分析不超过 5%。 (3)计算水的各种硬度 水的总硬度计算: H=[Ca2+]+[Mg2+] ,meq/L 暂时硬度计算: 计算水的暂时硬度时,需要考虑 Ca2+ 和 Mg2+ 的毫克当量总数与 HCO3 -毫克当量之 间的两种可能关系: ①、如[Ca2+ +Mg2+ ] ≤[HCO3 - ] (meq/L),则暂时硬度即等于总硬度。因为它不可能 大于总硬度; ②、当[Ca2+ +Mg2+ ] >[HCO3 - ]时,则水的暂时硬度小于总硬度,并等于的 HCO3 -的 含量( meq/L )。 永久硬度: 总硬度-暂时硬度=37.30—2.90=34.40 meq/L 。 (4)用库尔洛夫式表示水分析结果,并根据库尔洛夫表示式确定水的类型

Cl ssSO 14toHi CO M32 NaCa2将(阴离子)标示在横线上,将(阳离子)标示在横线下,按(毫克当量百分数)自大而小顺序排列,横线前依次是气体成分、特殊成分及(矿化度),三者单位是(g/l),横线后以字母t为代号表示以摄氏计的水温。3、地下水的类型P61表 6-2舒卡列夫分类:简明易懂,在我国广泛应用(1)根据地下水中六种主要离子,K+合并于Nat:(2)含量大于25meq/l阴离子、阳离子组合,分为49型水;(3)按矿化度分为A(40g/l)组(4)不同化学成分的水都可用一个简单的符号代替1-A型:矿化度40g/l,CI-Na型水4、地下水的化学成分的图示法P62,图64左下三角形的三边分别代表阳离子中Nat+K+、Ca2+、Mg2+的毫克当量百分数。阴离子CI、SO42-、HCO3表示在右下角三角形。水样的阴阳离子的相对含量分别在两个角形中标示。引线在菱形中得出的交点综合表示水样的阴阳离子相对含量,圆半径按比例表示矿化度。[课程小结]本章主要讲述了地下水的主要化学成分,地下水化学成分的形成作用,同学们要学会利用水化学形成作用分析地下水质随时空变化规律。主要讲述了地下水的主要化学成分,地下水化学成分的形成作用,水化学成分分析的内容、数据的处理,库尔洛夫化学表达式及舒卡列夫化学成分分类。[本讲作业及要求]:1、国外某一松散沉积物供水水源地,含水层中有石膏(CaSO4),由于超量开采,地下水位大幅度下降。结果,硬度大幅度上升,PH值明显下降。试述产生此现象的水文地球化学依据。2、某地有一潜水含水层,含水层为含少量硫化物的砂砾石层。由于过量开采,七年后,水位下降10m,水质也明显恶化:SO42一从20mg/L升至780mg/L,硬度(CaCO3)从113mg/L
将(阴离子)标示在横线上,将(阳离子)标示在横线下,按(毫克当量百分数)自大而小 顺序排列,横线前依次是气体成分、特殊成分及(矿化度),三者单位是(g/l),横线后以字 母 t 为代号表示以摄氏计的水温。 3、地下水的类型 P61 表 6-2 舒卡列夫分类:简明易懂,在我国广泛应用 (1) 根据地下水中六种主要离子,K+合并于 Na+; (2) 含量大于 25meq/l 阴离子、阳离子组合,分为 49 型水; (3) 按矿化度分为 A(40g/l)组 (4) 不同化学成分的水都可用一个简单的符号代替. 1- A 型: 矿化度40g/l,Cl-Na 型水 4、地下水的化学成分的图示法 P62,图 6-4 左下三角形的三边分别代表阳离子中 Na++K+、Ca2+、Mg2+的毫克当量百分数。阴离子 Cl-、SO4 2-、HCO3 -表示在右下角三角形。 水样的阴阳离子的相对含量分别在两个角形中标示。引线在菱形中得出的交点综合表示 水样的阴阳离子相对含量,圆半径按比例表示矿化度。 [课程小结]本章主要讲述了地下水的主要化学成分,地下水化学成分的形成作用,同学们要 学会利用水化学形成作用分析地下水质随时空变化规律。主要讲述了地下水的主要化学成 分,地下水化学成分的形成作用,水化学成分分析的内容、数据的处理,库尔洛夫化学表达 式及舒卡列夫化学成分分类。 [本讲作业及要求]: 1、 国外某一松散沉积物供水水源地,含水层中有石膏(CaSO4),由于超量开采,地下水位大 幅度下降。结果,硬度大幅度上升,PH 值明显下降。试述产生此现象的水文地球化学依 据。 2、 某地有一潜水含水层,含水层为含少量硫化物的砂砾石层。由于过量开采,七年后,水 位下降 10m,水质也明显恶化:SO42-从 20mg/L 升至 780mg/L,硬度(CaCO3)从 113mg/L
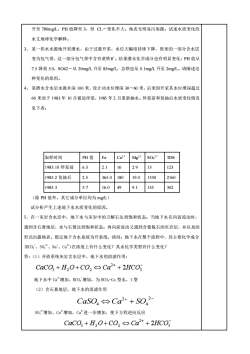
升至780mg/L,PH值降至3,但CL一变化不大。地表无明显污染源。试述水质变化的水文地球化学解释。3、某一供水水源地开采潜水,由于过量开采,水位大幅度持续下降,原来的一部分含水层变为包气带,这一部分包气带中含有黄铁矿。结果潜水化学成分也有明显变化:PH值从7.5降到5.0,SO42一从20mg/L升至85mg/L,总铁也从0.1mg/L升至2mg/L。请阐述这种变化的原因。4、某潜水含水层水源井深100米,设计动水位埋深30-60米,后来因开采其水位埋深超过60米而于1983年10月被迫停泵,1985年2月重新抽水。停泵前和复抽后水质变化情况见下表:取样时间FeCa2+PH值Mg2+SO.2TDS6.32.1162.9131231983.10停泵前2.51985.2复抽后365.018019.0133021605.79.11985.316.049135302(除PH值外,其它成分单位均为mg/L)试分析产生上述地下水水质变化的原因。5、在一灰岩含水层中,地下水与灰岩中的方解石达到饱和状态:当地下水在向前流动时,遇到含石膏地层,水与石膏达到饱和状态;再向前流动又遇到含蒙脱石的页岩层,并以泉的形式出露地表。假定地下含水系统为开系统,请问:地下水在整个流程中,其主要化学成分(HCO,、SO、Na、Ca)在浓度上有什么变化?其水化学类型有什么变化?答:(1)开放系统灰岩含水层中,地下水的溶滤作用:CaCO,+H,O+CO2Ca2++2HCO地下水中Ca增加、HCO增加,为HCOs-Ca型水,1型(2)含石膏地层,地下水的溶滤作用CaSO Ca2+ + SO?SO增加、Ca增加,Ca进一步增加,使下方程逆向反应CaCO + H,O+CO, Ca2++2HCO3
升至 780mg/L,PH 值降至 3,但 CL-变化不大。地表无明显污染源。试述水质变化的 水文地球化学解释。 3、 某一供水水源地开采潜水,由于过量开采,水位大幅度持续下降,原来的一部分含水层 变为包气带,这一部分包气带中含有黄铁矿。结果潜水化学成分也有明显变化:PH 值从 7.5 降到 5.0,SO42-从 20mg/L 升至 85mg/L,总铁也从 0.1mg/L 升至 2mg/L。请阐述这 种变化的原因。 4、 某潜水含水层水源井深 100 米,设计动水位埋深 30-60 米,后来因开采其水位埋深超过 60 米而于 1983 年 10 月被迫停泵,1985 年 2 月重新抽水。停泵前和复抽后水质变化情况 见下表: 取样时间 PH 值 Fe Ca2+ Mg2+ SO4 2- TDS 1983.10 停泵前 6.3 2.1 16 2.9 13 123 1985.2 复抽后 2.5 365.0 180 19.0 1330 2160 1985.3 5.7 16.0 49 9.1 135 302 (除 PH 值外,其它成分单位均为 mg/L) 试分析产生上述地下水水质变化的原因。 5、在一灰岩含水层中,地下水与灰岩中的方解石达到饱和状态;当地下水在向前流动时, 遇到含石膏地层,水与石膏达到饱和状态;再向前流动又遇到含蒙脱石的页岩层,并以泉的 形式出露地表。假定地下含水系统为开系统,请问:地下水在整个流程中,其主要化学成分 (HCO3 -、SO4 2-、Na+、Ca2+)在浓度上有什么变化?其水化学类型有什么变化? 答:(1)开放系统灰岩含水层中,地下水的溶滤作用: 地下水中 Ca2+增加、HCO3 -增加,为 HCO3-Ca 型水,1 型 (2)含石膏地层,地下水的溶滤作用 + − + 2 4 2 CaSO4 Ca SO SO4 2-增加、Ca2+增加,Ca2+进一步增加,使下方程逆向反应

HCO,含量减小。为SO,-HCO,-Ca型水,8型(3)含蒙脱石的页岩层中,发生阳离子交替吸附作用。Ca2+吸附能力>Na,又由于水中Ca2+的含量高,Ca2+替换页岩中粘土矿物所吸附的Na,Ca2+含量减小,Na含量增加,地下水的矿化度增大。为SO.-HCO-Ca-Na型水,11型。(4)以泉的形式出露地表。地下水上升至地表,压力降低,CO2的溶解度降低,发生脱碳酸作用。Ca+ +2HCO, →CO, 个+H,O+CaCO, ↓Ca2+含量减小、HCOs含量减小,为SO-Na型水,35型。6、某水样化学分析结果具有下列成分:Na*+Ka*1.72 meq/lCa+27.82meq/lMg2+9.48meq/lCI-0.83 meq/lSO.234.32 meq/lHCO;2.9 meq/l110℃时的干残余物2700mg/l游离CO217.80 mg/lHzs1.48 mg/l水温35℃分析其数据,写出库尔洛夫化学表达式。(注meq/l为毫克当量每升)(1)计算毫克当量百分数该离子毫克当量/升某阴(阳)离子的毫克当量百分数=×100%阴(阳)离子毫克当量总数/升(2)写出库尔洛夫式SO90.2COionh'SsMa CansM at°35
HCO3 -含量减小。为 SO4-HCO3-Ca 型水,8 型 (3)含蒙脱石的页岩层中,发生阳离子交替吸附作用。 2+ Ca 吸附能力> Na+,又由于水中 2+ Ca 的含量高, 2+ Ca 替换页岩中粘土矿物所吸附的 Na+, 2+ Ca 含量减小,Na+含量增加,地下水的矿化度增大。为 SO4-HCO3-Ca-Na 型水,11 型。 (4)以泉的形式出露地表。 地下水上升至地表,压力降低,CO2 的溶解度降低,发生脱碳酸作用。 + → + + + − 3 2 2 3 2 Ca 2HCO CO H O CaCO 2+ Ca 含量减小、 HCO3 -含量减小,为 SO4 –Na 型水,35 型。 6、某水样化学分析结果具有下列成分: Na++Ka+ 1.72 meq/l Ca2+ 27.82 meq/l Mg2+ 9.48 meq/l Cl- 0.83 meq/l SO4 2- 34.32 meq/l HCO3 - 2.9 meq/l 110℃时的干涸残余物 2700 mg/l 游离 CO2 17.80 mg/l H2S 1.48 mg/l 水温 35℃ 分析其数据,写出库尔洛夫化学表达式。(注 meq/l 为毫克当量每升) (1)计算毫克当量百分数 100% 阴(阳)离子毫克当量总数/升 该离子毫克当量/升 某阴(阳)离子的毫克当量百分数= (2)写出库尔洛夫式 35 71.3 24.9 4 90.2 0.0015 2.7 2 2 0.0178 t Ca Mg SO CO H S M )
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《水文地质学基础》课程授课教案(讲稿)第九章 地下水的动态与均衡.doc
- 《水文地质学基础》课程授课教案(讲稿)第七章 地下水的补给与排泄.doc
- 《水文地质学基础》课程授课教案(讲稿)第八章 地下水系统.doc
- 《水文地质学基础》课程授课教案(讲稿)第十章 孔隙水.doc
- 《水文地质学基础》课程授课教案(讲稿)课程总结.doc
- 《水文地质学基础》课程授课教案(讲稿)第十一章 裂隙水.doc
- 《水文地质学基础》课程授课教案(讲稿)第十二章 岩溶水.doc
- 《水文地质学基础》课程教学大纲 Hydrogeology(华北理工大学:马亚杰).doc
- 《基础工程》课程教学资源(PPT课件)第1章 绪论 Foundation Engineering.ppt
- 《基础工程》课程教学资源(PPT课件)第4章 桩基础.ppt
- 《基础工程》课程教学资源(PPT课件)第2章 浅基础.ppt
- 《基础工程》课程教学资源(PPT课件)第3章 连续基础.ppt
- 《基础工程》课程教学资源(PPT课件)第6章 特殊土地基.ppt
- 《基础工程》课程教学资源(PPT课件)第7章 地基承载力.ppt
- 《基础工程》课程教学资源(PPT课件)第5章 挡土墙.ppt
- 《基础工程》课程练习习题二(含答案).pdf
- 《基础工程》课程练习习题六(含答案).pdf
- 《基础工程》课程练习习题五(含答案).pdf
- 《基础工程》课程练习习题三(含答案).pdf
- 《基础工程》课程练习习题四(含答案).pdf
- 《水文地质学基础》课程授课教案(讲稿)第三章 地下水的赋存.doc
- 《水文地质学基础》课程授课教案(讲稿)第二章 岩石中的孔隙与水分.doc
- 《水文地质学基础》课程授课教案(讲稿)第四章 地下水运动的基本规律 §3 流网.doc
- 《水文地质学基础》课程授课教案(讲稿)第四章 地下水运动的基本规律 §1 水力学的基本概念 §2 重力水运动的基本规律.doc
- 《水文地质学基础》课程授课教案(讲稿)第一章 地球上的水及循环.doc
- 《水文地质学基础》课程授课教案(讲稿)绪论 Introduction to hydrogeology.doc
- 《水文地质学基础》课程教学资源(试卷习题)作业习题(无答案).doc
- 《水文地质学基础》课程教学资源(试卷习题)部分习题答案.docx
- 《水文地质学基础》课程教学资源(重点难点)地下水化学作用.ppt
- 《水文地质学基础》课程教学资源(重点难点)地下水运动的基本规律.ppt
- 《水文地质学基础》课程教学资源(试卷习题)试卷6及答案.doc
- 《水文地质学基础》课程教学资源(试卷习题)试卷5(题目).doc
- 《水文地质学基础》课程教学资源(试卷习题)试卷5(答案).doc
- 《水文地质学基础》课程教学资源(试卷习题)试卷3(答案).doc
- 《水文地质学基础》课程教学资源(试卷习题)试卷2(答案).doc
- 《水文地质学基础》课程教学资源(试卷习题)试卷3(题目).doc
- 《水文地质学基础》课程教学资源(试卷习题)试卷1(答案).doc
- 《水文地质学基础》课程教学资源(试卷习题)试卷1(题目).doc
- 《水文地质学基础》课程教学资源(试卷习题)试卷2(题目).doc
- 《质量管理与可靠性》课程教学大纲 Quality Managment and Reliability.doc
