西北大学:《普通化学》课程教学资源(PPT课件)第五章 酸、碱和酸碱反应 Acid, base & acid-base reaction

第5章 酸、碱和酸碱反应 ChapterS Acid,base acid-base reaction
第5章 酸、碱和酸碱反应 Chapter 5 Acid, base & acid-base reaction

5.1 布朗斯特酸碱理论 The Bronsted-Lowry acid-base model 5.2 路易斯酸碱理论 The Lewis acid-base model 5.3 弱酸、弱碱、水溶 Weak acid,weak base and the transfer of a 液的质子转移平衡 proton in the autoionication of water 5.4 盐的水解 Hydrolysis of salts 5.5缓冲溶液 Buffer solution 章首 结束
5.1 布朗斯特酸碱理论 5.2 路易斯酸碱理论 5.5 缓冲溶液 5.3 弱酸、弱碱、水溶 液的质子转移平衡 The Bronsted-Lowry acid-base model The Lewis acid-base model Buffer solution Weak acid, weak base and the transfer of a proton in the autoionication of water 5.4 盐的水解 Hydrolysis of salts

Cave formation result from acid-base reaction involving CacCOs 止页下页 节首节尾
3 Cave formation result from acid-base reaction involving CaCO3

酸碱的概念在不断地发展.让我们先回忆一下Arrhenius 的“电离说”, 然后再介绍Bronsted-lowry酸碱理论和Lewis 酸碱理论 l887年Arrhenius提出“电离说”(Arrhenius acid-.base concept) 酸指在水中电离出的阳离子全部为H+,都不是离子型化合物: H,SO=HSO1+H+ 碱指在水中电离出的阴离子全部为O,全为离子型化合物: NaOH=Na+OH- 中和反应的实质是H+OH=H2O 水溶液中电解质(electrolyte)是部分电离的: 己电离的溶质粒子数 ×100% 原有溶质的粒子数 c-电离度(degree of ionization)) 止页下页节首节尾
4 1887年Arrhenius提出“电离说” (Arrhenius acid-base concept) ● 酸指在水中电离出的阳离子全部为H+ ,都 不是离子型化合物: ● 碱指在水中电离出的阴离子全部为OH-, 全为离子型化合物: H2SO4 = HSO- 4 + H+ NaOH = Na+ + OH- ● 中和反应的实质是 H+ + OH- = H2O ● 水溶液中电解质(electrolyte )是部分电离的: 100% 原有溶质的粒子数 已电离的溶质粒子数 -电离度(degree of ionization) 酸碱的概念在不断地发展. 让我们先回忆一下Arrhenius 的“电离说” ,然后再介绍Bronsted-lowry酸碱理论和Lewis 酸碱理论

5.1布朗斯特酸碱理论(酸碱质子理论) the Bronsted-lowry aeid-base model 5.1.1定义 5.1.2共轭酸碱对 5.1.3 布朗斯特平衡 5.1.4溶剂的拉平效应 5.1.5羟基酸 布朗斯特 (Brfnsted J N,1879-1947) 5.1.6氧化物的酸碱性 丹麦物理化学家。因其酸、碱质子理论而 著名于世. 上页 下页 节首 节尾
5 5.1.1 定义 5.1.2 共轭酸碱对 5.1.3 布朗斯特平衡 5.1.4 溶剂的拉平效应 5.1.5 羟基酸 5.1 布朗斯特酸碱理论 (酸碱质子理论) the Bronsted-lowry aeid-base model 5.1.6 氧化物的酸碱性 布朗斯特 (Brfnsted J N, 1879-1947) 丹麦物理化学家. 因其酸、碱质子理论而 著名于世

5.1.1 定义(definition) 1923年由Bronsted J N和LowryTM提出: 酸:反应中任何能给出质子的分子或离子,即质子给予体 碱:反应中任何能接受质子的分子或离子,即质子接受体 酸碱反应是指质子由质子给予体向质子接受体的转移过程 由于该定义不涉及发生质子转移的环境,故而在气相和任何溶 剂中均通用. HF(g)+H2O(1)H;O+(ag)+F-(ag) HF(ag)+NH3(ag)NH"(ag)+F-(ag) 水 H2O(1)+NH;(ag)-OH-(ag)+NHa"(ag) 两性 H2S(ag)+H2O(1)H3O+(ag)+H3S+(ag) 上页下页 节首 节尾
6 酸:反应中任何能给出质子的分子或离子,即质子给予体 碱:反应中任何能接受质子的分子或离子,即质子接受体 酸碱反应是指质子由质子给予体向质 子接受体的转移过程 5.1.1 定义(definition) 1923年由Brfnsted J N和Lowry TM提出: 由于该定义不涉及发生质子转移的环境,故而在气相和任何溶 剂中均通用. HF(g) + H2O(l) →H3O+(ag) + F-(ag) HF(ag) + NH3(ag) →NH4 +(ag) + F-(ag) H2O(l) + NH3(ag) →OH-(ag) + NH4 +(ag) H2S(ag) + H2O (l) →H 3O+ (ag) + H4S+(ag) 水 是 两 性
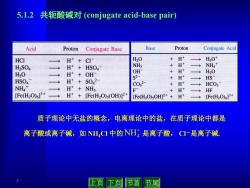
5.l.2共轭酸碱对(conjugate acid-.base pair) Acid Proton Conjugate Base Base Proton Conjugate Acid HCI H++C1 H20 + H+ H30 H2SO4 H+HSO4 NH3 H+ NH4+ H20 H++OHΓ OH +H+ H20 S2- HS HSO4 H++S042 +H+ → C032- H+ HCO3 NHA* 二 H++NH3 F +H+ HF [Fe(H2O)63+ H*+[Fe(H2O)s(OH)]2+ [Fe(H2O)sOH]2++ H+ [Fe(H2O)6]3+ 质子理论中无盐的概念,电离理论中的盐,在质子理论中都是 离子酸或离子碱,如NH,CI中的NH是离子酸,C一是离子碱 止页下页 节首节尾
7 5.1.2 共轭酸碱对 (conjugate acid-base pair) 质子理论中无盐的概念,电离理论中的盐,在质子理论中都是 离子酸或离子碱,如 NH4Cl 中的 是离子酸, Cl-是离子碱. NH4

(1)酸碱反应的实质 两个共轭酸碱对之间的质子传递 H H)-CI:+:N-H H-N-H+:Cl: H H HCI NH3 之 NH4+ CI Acid Base2 Acid2 Base 酸越强,其共轭碱越弱;碱越强,其共轭酸越弱 ●反应总是由相对较强的酸和碱向生成相对较弱的酸和碱的方向进行 ● 对于某些物种而言,是酸是碱取决于参与的具体反应 上页下页 节首 节尾
8 两个共轭酸碱对之间的质子传递 ● 酸越强,其共轭碱越弱;碱越强,其共轭酸越弱 ● 反应总是由相对较强的酸和碱向生成相对较弱的酸和碱的方向进行 ● 对于某些物种而言,是酸是碱取决于参与的具体反应 (1)酸碱反应的实质
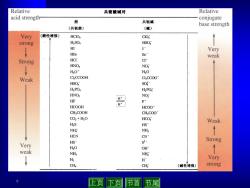
Relative 共轭酸碱对 Relative acid strength conjugate 酸 共轭碱 base strength (共轭酸) (碱) Very (酸性增强) HCIO, CIO strong H2S04 HSO ↑ HI I Very HBr Br weak Strong HCI c HNO NO H3O* H2O Weak ClCCOOH ClCCOo HSO sO HPO H2PO HNO2 NO HF H HCOOH F HCOO CH,COOH CHCOO CO2+H2O HCO Weak H2S HS NH NHs HCN CN HS Strong Very s2- H2O OH weak NHs NH2 ↓ H H Very CH CHi (碱性增强) strong 9 上页下页 节首 节尾
9

(2)酸碱反应的类型 ●酸和碱的离解反应 + H H ⑩-C1:+:O-H≥ H-O-H+:CI: HCI H20 公 H3O* CI Acid Base2 Acid, Base H H H O-④+:N-H H一N一H +H-0: H H H20+ NH3 NH4* OH Acid Base Acid, Base H H H 0-+:0-H 三 H-0-H+H-0: H20+ H2O H3O* + OH Acid Base2 Acid, Base 10 止页 下页 节首 节尾
10 (2)酸碱反应的类型 ● 酸和碱的离解反应
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西北大学:《普通化学》课程教学资源(PPT课件)第九章 s区元素 s-Block Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十九章 配合物(配位化学基础知识).ppt
- 四川大学:《物理化学》课程教学资源(课件讲稿)第二章 多组分系统热力学.pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)第5章 糖类代谢.pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)第3章 核酸(nucleic acid).pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)实验指导书(共二十六个实验).pdf
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十四章 糖类化合物.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十三章 油脂和类脂.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十二章 杂环化合物(heterocyclic compound).ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十章 含氮有机化合物.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第九章 羧酸、羧酸衍生物和取代酸.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第八章 醛、酮、醌.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第七章 醇、酚、醚.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第六章 卤代烃.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第五章 旋光异构体.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第三章 不饱和脂肪烃.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第一章 绪论 ORGANIC CHEMISTRY(主讲:杨爱萍).ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第九章 代谢调节.ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第八章 蛋白质的生物合成(2/2).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十四章 氢 Hydrogen.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第七章 化学动力学基础 Primary of Chemical Reaction Kinetics.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第八章 水溶液 Water Solution.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十七章 碳硅硼 Carborn Silicon and Boron.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十三章 氢和稀有气体 Hydrogen and rare gases.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十章 沉淀平衡 Precipitation-dissolution equilibrium.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第七章 芳香烃 Aromatic compounds.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第六章 有机化合物的结构表征.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十一章 醛、酮、醌.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十九章 氨基酸、多肽、蛋白质和核酸 Amino Acids, Peptides and Nucleic acids.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第十二章 羧酸衍生物.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第三章 不饱和烃(3.1-3.4).ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第四章 二烯烃和共轭体系.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十八章 杂环化合物.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第二章 核酸的结构与功能.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第四章 三酸酸循环和氧化磷酸化.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第七章 含氮化合物代谢.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第十章 氢离子代谢(酸碱代谢).ppt
- 山西医科大学:《生物化学》课程教学课件(讲稿)第2章 糖与糖复合物 Carbohydrate and Glycoconjugate.pdf
