西北大学:《普通化学》课程教学资源(PPT课件)第十四章 氢 Hydrogen

第14章氢 Chapter 14 Hydrogen
第 14 章 氢 Chapter 14 Hydrogen

He Li Be B N Ne Na Mg H Si CI A虹 K Ca Sc Ti V Cr Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Ag Cd In Sn Sb Te I Xe Cs La- Lf Ta Ir Pf TI Ph Bi Rn 氢是周期表中唯一尚未找到确切位 118 置的元素! 。 sblo La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr block
H 氢是周期表中唯一尚未找到确切位 置的元素.· · · · · ·

本章教学要求 了解氢在周期表中的位置; 了解氢的存在和用途,掌握氢的主要工业和实 验室制法; 3.认识氢的三种同位素 4. 掌握二元氢化物的分类及其特点; 5. 了解氢能源(发生、储存、利用)·
1. 了解氢在周期表中的位置; 本章教学要求 5. 了解氢能源(发生、储存、利用). 4. 掌握二元氢化物的分类及其特点; 3. 认识氢的三种同位素; 2. 了解氢的存在和用途,掌握氢的主要工业和实 验室制法;

14.1 本章内容 存在、制备和用途 occurrence,preparation and use 14.2 核性质 nuclear properties 14.3 二元氢化合物的分类 classification of binary hydride 14.4 氢的性质和反应 properties and reactions of hydrogen
本 章 内 容 14.1 存在、制备和用途 occurrence,preparation and use 14.2 核性质 nuclear properties 14.3 二元氢化合物的分类 classification of binary hydride 14.4 氢的性质和反应 properties and reactions of hydrogen
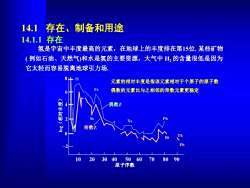
14.1存在、制备和用途 14.1.1存在 氢是宇宙中丰度最高的元素,在地球上的丰度排在第15位.某些矿物 (例如石油、天然气)和水是氢的主要资源,大气中H2的含量很低是因为 它太轻而容易脱离地球引力场 元素的相对丰度是指该元素相对于个原子的原子数 偶数的元素比与之相邻的奇数元素更稳定 偶数乙 奇数Z 10 2030405060708090 原子序数
14.1.1 存在 氢是宇宙中丰度最高的元素,在地球上的丰度排在第15位. 某些矿物 ( 例如石油、天然气)和水是氢的主要资源,大气中 H2的含量很低是因为 它太轻而容易脱离地球引力场. 14.1 存在、制备和用途 10 20 30 40 50 60 70 80 90 8 6 4 2 0 –2 Pb Bi Pb Th Xe Sc Fe O 原子序数 lo g(相 对 丰 度) 偶数Z 奇数Z 元素的相对丰度是指该元素相对于个原子的原子数 偶数的元素比与之相邻的奇数元素更稳定

★ 氢的存在状态 氢的状态 金属氢(S) 液态氢① 固态氢(s) 密度gcm3 0.562 0.071 0.089 3x10%kPa H2(g) (s) 11000K H2(g) .5x10kPaH(s) 77K 金刚石砧 大气层顶 ★木星结构 云层顶 根据先锋飞船探测得知, 瓷志金量 岩石核心 木星大气含氢82%,氨17%, 其它元素<1%
大 气 层 顶 云 层 顶 液 氢 液态金属氢 岩 石 核 心 ★ 木星结构 根据先锋飞船探测得知, 木星大气含氢82%,氦17%, 其它元素<1%. ★ 氢的存在状态 (s) 11000K 3 10 kPa H (g) 8 2 属氢 H(s) 77K 2.5 10 kPa H (g) 8 2 金刚石砧 氢的状态 金属氢(s) 液态氢(l) 固态氢(s) 密度/g·cm-3 0.562 0.071 0.089
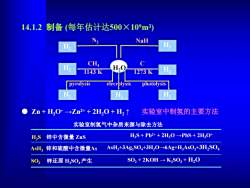
14.1.2制备(每年估计达500×10m3) NaH H H CH 1143K 1273K H, pyrolysis elecrplysis photolysis Zn+H30→Zn2++2H20+H2↑ 实验室中制氢的主要方法 实验室制氢气中杂质来源与除去方法 HS 锌中含微量ZnS H2S+Pb2++2H2O-PbS+2H3O+ AsH3锌和硫酸中含微量As AsH3+3Ag2SO+3H2O-6Ag+H3AsO3+3H2SO S02 锌还原H2S0,产生 S02+2KOH→KS03+H2O
14.1.2 制备 (每年估计达500×109m3) ● Zn + H3O+ →Zn2+ + 2H2O + H2 ↑ 实验室中制氢的主要方法 实验室制氢气中杂质来源与除去方法 H2S + Pb2+ + 2H2O →PbS + 2H3O+ AsH3 锌和硫酸中含微量As AsH3+3Ag2SO4+3H2O→6Ag+H3AsO3+3H2SO4 H2S 锌中含微量 ZnS SO2 锌还原 H2SO4产生 SO2 + 2KOH → K2SO3 + H2O H2O H2 H2 H2 H2 H2 H2 H2 N2 NaH C 1273 K CH4 1143 K pyrolysis elecrolysis photolysis

当今制氢最经济的原料是煤和以甲烷为主要成分的天然气,而 且都是通过与水(最廉价的氢资源)的反应实现的 水蒸气转化法 CH(g)+H2O(g)-1273K3 H2(g)+CO(g) 其中产物氢的三分之一来自水 水煤气反应 C (s)+H2O(g) 1273K H2(g)+CO(g) 其中产物氢的百分之百来自水, H2(g)+COg)就是水煤气,可做工业燃料,使用时不必分离。 但若为了制氢,必须分离出CO. 可将水煤气连同水蒸气一起通过红热的氧化铁催化剂,C0 变成CO2,然后在2×106下用水洗涤C02和H2的混合气体,使 C02溶于水而分离出H2 C0+H2+H,0g)e0 一C02+2H >723K
当今制氢最经济的原料是煤和以甲烷为主要成分的天然气,而 且都是通过与水(最廉价的氢资源)的反应实现的. 水蒸气转化法 CH4(g) + H2O(g) 3 H2(g) + CO(g) 1 273 K 其中产物氢的三分之一来自水. 水煤气反应 C (s) + H2O(g) H2(g) + CO(g) 1 273 K 其中产物氢的百分之百来自水. H2(g) + CO(g) 就是水煤气,可做工业燃料,使用时不必分离. 但若为了制氢,必须分离出CO. 可将水煤气连同水蒸气一起通过红热的氧化铁催化剂, CO 变成 CO2 ,然后在 2×106 下用水洗涤 CO2和 H2的混合气体,使 CO2溶于水而分离出 H2 . CO + H2 + H2O(g) CO2 + 2 H2 Fe2O3 > 723 K

用焦炭或天然气与水反应制H2,为什么 都需在高温下进行? 因为这两个反应都是吸热反应: CH(g)+H2O(g) 3H(g)+C0(g),Hm=206.0kJmo1 C(S)+H20(g ,H2(g)+CO(g), ,△Hm=131.3 kJ.mol-1 要反应得以进行,则需供给热量,如添加空气或氧气燃烧: C+02 C029 △Hm=-393.7kJmo1 CH4+202 .C02+2H20, △Hm=-803.3 kJ-mol-1 这样靠“内部燃烧”放热,供焦炭或天然气与水作用所需热量 ,无须从外部供给热量,这是目前工业上最经济的生产氢的方法
Question 1 用焦炭或天然气与水反应制 H2 ,为什么 都需在高温下进行? 因为这两个反应都是吸热反应: CH4(g) + H2O(g) 3 H2(g) + CO(g),ΔHθ m = 206.0 kJ•mol–1 C (s) + H2O(g) H2(g) + CO(g), ΔHθ m = 131.3 kJ•mol–1 要反应得以进行,则需供给热量,如添加空气或氧气燃烧: C + O2 CO2 , ΔHθ m = –393.7 kJ•mol–1 CH4 + 2 O2 CO2 + 2 H2O, ΔHθ m = – 803.3 kJ•mol–1 这样靠“内部燃烧”放热,供焦炭或天然气与水作用所需热量 ,无须从外部供给热量,这是目前工业上最经济的生产氢的方法

● 热化学循环法制H2 2H,O(I)+SO,+I,(s)-298K>H,SO.(aq)+2HI(aq) HS0,(g)7K>H,0g)+S0,(g)+,0,(g 2HI(g)73→H,(g)+12(g) 净反应 H,0g)→H,g)+0.(g 电解20%NaOH或15%KOH水溶液,耗能大,效率也只32% 40H→02+2H,0+4e(阳极) 2H20+2e→20H+H2(阴极) 加热(383一423K加压(1013一3039kPa),效率可提高到90%以上
● 热化学循环法制 H2 O (g) 2 1 H O(g) H (g) 2HI(g) H (g) I (g) O (g) 2 1 H SO (g) H O(g) SO (g) 2H O(l) SO I (s) H SO (aq) 2HI(aq) 2 2 1300K 2 2 2 873K 2 4 2 1073K 2 4 2 4 298K 2 2 2 净反应 加热(383—423K)加压(1013—3039kPa),效率可提高到 90% 以上. ● 电解 20% NaOH或 15% KOH水溶液,耗能大,效率也只 32% 4OH- → O2+2H2O + 4e - (阳极) 2H2O +2e - → 2OH- + H2 (阴极)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西北大学:《普通化学》课程教学资源(PPT课件)第五章 酸、碱和酸碱反应 Acid, base & acid-base reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第九章 s区元素 s-Block Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十九章 配合物(配位化学基础知识).ppt
- 四川大学:《物理化学》课程教学资源(课件讲稿)第二章 多组分系统热力学.pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)第5章 糖类代谢.pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)第3章 核酸(nucleic acid).pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)实验指导书(共二十六个实验).pdf
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十四章 糖类化合物.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十三章 油脂和类脂.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十二章 杂环化合物(heterocyclic compound).ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十章 含氮有机化合物.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第九章 羧酸、羧酸衍生物和取代酸.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第八章 醛、酮、醌.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第七章 醇、酚、醚.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第六章 卤代烃.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第五章 旋光异构体.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第三章 不饱和脂肪烃.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第一章 绪论 ORGANIC CHEMISTRY(主讲:杨爱萍).ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第九章 代谢调节.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第七章 化学动力学基础 Primary of Chemical Reaction Kinetics.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第八章 水溶液 Water Solution.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十七章 碳硅硼 Carborn Silicon and Boron.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十三章 氢和稀有气体 Hydrogen and rare gases.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十章 沉淀平衡 Precipitation-dissolution equilibrium.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第七章 芳香烃 Aromatic compounds.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第六章 有机化合物的结构表征.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十一章 醛、酮、醌.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十九章 氨基酸、多肽、蛋白质和核酸 Amino Acids, Peptides and Nucleic acids.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第十二章 羧酸衍生物.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第三章 不饱和烃(3.1-3.4).ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第四章 二烯烃和共轭体系.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十八章 杂环化合物.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第二章 核酸的结构与功能.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第四章 三酸酸循环和氧化磷酸化.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第七章 含氮化合物代谢.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第十章 氢离子代谢(酸碱代谢).ppt
- 山西医科大学:《生物化学》课程教学课件(讲稿)第2章 糖与糖复合物 Carbohydrate and Glycoconjugate.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第3章 脂类与复合脂 Lipids and Lipid Complex.pdf
