西昌学院:《无机化学》课程教学资源(PPT课件)第七章 化学动力学基础 Primary of Chemical Reaction Kinetics

第7章 化学动力学基础 Pismary of Chencalgractan Kincties
第7章 化学动力学基础 Chapter 7 Primary of Chemical Reaction Kinetics

本章要求 1、建立反应速度的概 念。 2、理解速率方程(质 量作用定律)和阿仑尼 乌斯方程; 3、初步理解反应机理 (反应历程)的概念; 4、理解解释基元反应 的速率方程的碰撞理 论和解释阿仑尼乌斯 方程的过渡态理论; 随着空气中的二氧化硫的浓度的增 5、简介催化反应。 加使得酸雨的浓度也在增加.结果,文物 被腐蚀的速度也在加快。 止页下节首节尾
2 随着空气中的二氧化硫的浓度的增 加使得酸雨的浓度也在增加.结果,文物 被腐蚀的速度也在加快. 本章要求 1、建立反应速度的概 念。 2、理解速率方程(质 量作用定律)和阿仑尼 乌斯方程; 3、初步理解反应机理 (反应历程)的概念; 4、理解解释基元反应 的速率方程的碰撞理 论和解释阿仑尼乌斯 方程的过渡态理论; 5、简介催化反应

7,1化学反应速率 7.2浓度对化学反应的影响 7.3 温度对反应速率的的影响及阿仑尼乌斯公式 7.4反应历程 7.5 碰撞理论和过渡态理论 7.6催化剂对反应速度的影响 章首 结束
7.1 化学反应速率 7.3 温度对反应速率的的影响及阿仑尼乌斯公式 7.2 浓度对化学反应的影响 7.4 反应历程 7.5 碰撞理论和过渡态理论 7.6 催化剂对反应速度的影响
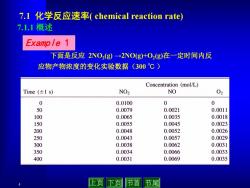
7.l化学反应速率(chemical reaction rate) 7.1.1概述 Example 1 下面是反应2NO2(g)→2NO(g+O2g)在一定时间内反 应物产物浓度的变化实验数据(300℃) Concentration (mol/L) Time(±1s) NO2 NO 02 0 0.0100 0 0 50 0.0079 0.0021 0.0011 100 0.0065 0.0035 0.0018 150 0.0055 0.0045 0.0023 200 0.0048 0.0052 0.0026 250 0.0043 0.0057 0.0029 300 0.0038 0.0062 0.0031 350 0.0034 0.0066 0.0033 400 0.0031 0.0069 0.0035 上页 下页 节首 节尾
4 7.1 化学反应速率( chemical reaction rate) 下面是反应 2NO2(g) →2NO(g)+O2(g)在一定时间内反 应物产物浓度的变化实验数据(300 ℃ ) Example 1 7.1.1 概述

0.010m 把表中数据画在图上得到了3条曲线,显 然,反应物随反应进行浓度在不断减小,生 成物浓度却在不断增加. 1.000M 0.500M 0.250M 0.125M 0.0625M 0s 2.16×104s 4.32×104s 6.48×104s 8.64×104s (0h) (6h) (12h) (18h) (24h) 上页 下页 节首 节尾
5 把表中数据画在图上得到了3条曲线,显 然,反应物随反应进行浓度在不断减小,生 成物浓度却在不断增加
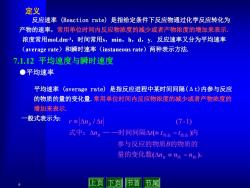
定义 反应速率(Reaction rate)是指给定条件下反应物通过化学反应转化为 产物的速率,常用单位时间内反应物浓度的减少或者产物浓度的增加来表示. 浓度常用mol.dmr3,时间常用s,min,h,d,y.反应速率又分为平均速率 (average rate)和瞬时速率(instaneous rate)两种表示方法 7.1.12平均速度与瞬时速度 ●平均速率 平均速率(average rate)是指反应进程中某时间间隔(△t)内参与反应 的物质的量的变化量.常用单位时间内反应物浓度的减少或者产物浓度的 增加来表示 一般式表示为: r≡△na/△ (7-1) 式中:△n。一一时间间隔△(但1终态-1始态)内 参与反应的物质B的物质的 量的变化数(△ng≡n终-n始)。 6 上页下页 节首 节尾
6 反应速率 (Reaction rate) 是指给定条件下反应物通过化学反应转化为 产物的速率,常用单位时间内反应物浓度的减少或者产物浓度的增加来表示. 浓度常用mol.dm-3,时间常用s,min,h,d,y. 反应速率又分为平均速率 (average rate)和瞬时速率(instaneous rate)两种表示方法. 定义 ●平均速率 7.1.12 平均速度与瞬时速度 平均速率 (average rate) 是指反应进程中某时间间隔(Δt)内参与反应 的物质的量的变化量.常用单位时间内反应物浓度的减少或者产物浓度的 增加来表示. 一般式表示为: 量的变化数 。 参与反应的物质 的物质的 式中: — —时间间隔 内 终 始 终态 始态 ( ) ( ) / n n n B n t t t r n t B B B (7 -1)

对于在体积一定的密闭容器内进行的化学反应,常用单位时间内反应物浓 度的减少或者产物浓度的增加来表示。 一般式表示为: r=△cB/△1 (7-2) 式中:△Cg一一时间间隔△(信1终态一t始态)内 参与反应的物质B的物质的 量的变化数(△cg≡c终-C始) 取绝对值的原因:反应速率不管大小,总是正值, 用浓度的变化量表示平均反应速度,表达式可能不一样.如:3H2+N22NH3 r=-△C(H,)/△ 取一般通式: r'=-△c(N2)/△M r≡(1/ya)△cB/△1(7-3) r"=△cNH)/Ar V。是物质B在配平的化学方程式中的化学计量数。 化学计量数的数符规定一反应物负值,生成物正值。 上顶 下页 节首节尾
7 对于在体积一定的密闭容器内进行的化学反应,常用单位时间内反应物浓 度的减少或者产物浓度的增加来表示. 一般式表示为: 量的变化数 。 参与反应的物质 的物质的 式中: — —时间间隔 内 终 始 终态 始态 ( ) ( ) / c c c B c t t t r c t B B B (7 - 2) 取绝对值的原因:反应速率不管大小,总是正值. 用浓度的变化量表示平均反应速度,表达式可能不一样.如: 3H2+N2=2NH3 r c NH t r c N t r c H t ( )/ ( )/ ( )/ '' ' 3 2 2 取一般通式: 化学计量数的数符规定 反应物负值,生成物正值。 是物质 在配平的化学方程式中的化学计量数。 B r c t B B B (1/ ) / (7 - 3)

瞬时速率 Example 2 2N20=4N02+02,用反应物和产物表示都可以 Rate of consumption Rate of production (Rate of production of N2Os of NO2 of02) 1△cN2Os) 1△cNO) 一一X 一X △c(O2) 21 △M 4 △t △ 对于一般的化学反应: r≡(I/va)dca/d0 aA +bB yY 3Z dcB dcy dcz YE- adt bdt ydt zdt ▲实际工作中如何选择,往往取决于哪一种物质更易通过试验 监测其浓度变化 ▲速率方程相同,但各自的不同。 上页下页 节首 节尾
8 Rate of consumption of N2O5 Rate of production of NO2 (Rate of production of O2 = = ) t c ( 5) N2O 2 1 t c (NO) 4 1 t c O ( ) 2 = = z t c y t c b t c a t c r d d d d d d d d A B Y Z aA + bB yY + zZ ▲实际工作中如何选择,往往取决于哪一种物质更易通过试验 监测其浓度变化. ▲速率方程相同,但各自的k不同. 对于一般的化学反应: 2N2O5=4NO2+O2 , 用反应物和产物表示都可以 Example 2 r dc dt B B (1/ ) / ● 瞬时速率

u® 反应2W+X一Y+Z哪种速率表达式是正确的? dc(X) dc(Y) a dt dt b. dc(X) dc(W dt dt de(Z) C. de(Y) dt dt d. dc(Z) de(W) dt dt 9 止页下页 节首节尾
9 Question 1 反应 2W+X Y+Z 哪种速率表达式是正确的? t c W t c Z t c Y t c Z t c W t c X t c Y t c X d d d d d d d d d d d d d d d d d c b. a. ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) . .
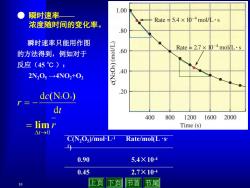
1.00 瞬时速率 Rate5.4×10-4mol/L·s 浓度随时间的变化率。 .80 瞬时速率只能用作图 11110m Rate¥2.7×10-4mol/L·s 的方法得到,例如对于 .60 反应(45℃): .40 2N205→4N02t02 dc(N2O,) .20 r= dt 400 800 12001600 2000 三 limr Time(s) △1-→0 C(N2Os)/mol-L-1 Rate/mol(Ls 0.90 5.4×104 0.45 2.7×104 10 止页 下页 节首节尾
10 r t0 lim ● 瞬时速率—— 浓度随时间的变化率。 t c r d d (N2O5) C(N2O5)/mol·L-1 Rate/mol(L ·s - 1) 0.90 5.4×10-4 0.45 2.7×10-4 瞬时速率只能用作图 的方法得到,例如对于 反应(45 ℃ ): 2N2O5 →4NO2+O2
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西北大学:《普通化学》课程教学资源(PPT课件)第十四章 氢 Hydrogen.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第五章 酸、碱和酸碱反应 Acid, base & acid-base reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第九章 s区元素 s-Block Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十九章 配合物(配位化学基础知识).ppt
- 四川大学:《物理化学》课程教学资源(课件讲稿)第二章 多组分系统热力学.pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)第5章 糖类代谢.pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)第3章 核酸(nucleic acid).pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)实验指导书(共二十六个实验).pdf
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十四章 糖类化合物.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十三章 油脂和类脂.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十二章 杂环化合物(heterocyclic compound).ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十章 含氮有机化合物.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第九章 羧酸、羧酸衍生物和取代酸.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第八章 醛、酮、醌.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第七章 醇、酚、醚.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第六章 卤代烃.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第五章 旋光异构体.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第三章 不饱和脂肪烃.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第一章 绪论 ORGANIC CHEMISTRY(主讲:杨爱萍).ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第八章 水溶液 Water Solution.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十七章 碳硅硼 Carborn Silicon and Boron.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十三章 氢和稀有气体 Hydrogen and rare gases.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十章 沉淀平衡 Precipitation-dissolution equilibrium.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第七章 芳香烃 Aromatic compounds.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第六章 有机化合物的结构表征.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十一章 醛、酮、醌.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十九章 氨基酸、多肽、蛋白质和核酸 Amino Acids, Peptides and Nucleic acids.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第十二章 羧酸衍生物.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第三章 不饱和烃(3.1-3.4).ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第四章 二烯烃和共轭体系.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十八章 杂环化合物.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第二章 核酸的结构与功能.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第四章 三酸酸循环和氧化磷酸化.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第七章 含氮化合物代谢.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第十章 氢离子代谢(酸碱代谢).ppt
- 山西医科大学:《生物化学》课程教学课件(讲稿)第2章 糖与糖复合物 Carbohydrate and Glycoconjugate.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第3章 脂类与复合脂 Lipids and Lipid Complex.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第5章 酶与其他生物催化剂 Enzymes and Other Biocatalysts.pdf
