陕西科技大学:《有机化学》课程教学资源(PPT课件)第三章 不饱和烃(3.1-3.4)

第三章不饱和烃 (一)烯烃和炔烃的结构 (二)烯烃和炔烃的同分异构 (三)烯烃和炔烃的命名 (四)烯烃的物理性质 (五)烯烃和炔烃的化学性质 (六)烯烃和炔烃的工业来源和制法 团
第三章 不饱和烃 (一) 烯烃和炔烃的结构 (二) 烯烃和炔烃的同分异构 (三) 烯烃和炔烃的命名 (四) 烯烃的物理性质 (五) 烯烃和炔烃的化学性质 (六) 烯烃和炔烃的工业来源和制法

第三章不饱和烃 含有碳碳重键(C=C或C=C)的开链烃称为不饱和烃。 例如: 名称 通式 官能团 化合物举例 烯烃 CH2m C-C CH2=CH2 CH3 CH=CH2 炔烃 CHan2 -C≡C CH=CH、CHC=CCH3 烯炔 C=C和C≡C CH2=CH-C≡CH 回
第三章 不饱和烃 含有碳碳重键(C=C或C≡C)的开链烃称为不饱和烃。 例如:

(一)烯烃和炔烃的结构 (1)烯烃的结构 (2)炔烃的结构 国
(一) 烯烃和炔烃的结构 (1) 烯烃的结构 (2) 炔烃的结构
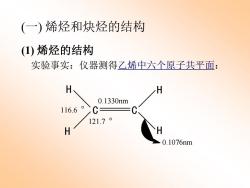
(一)烯烃和炔烃的结构 (1)烯烃的结构 实验事实:仪器测得乙烯中六个原子共平面: H H 0.1330nm 116.6°>C 121.7o H H 0.1076nm
(一) 烯烃和炔烃的结构 (1) 烯烃的结构 实验事实:仪器测得乙烯中六个原子共平面: C C H H H H 0.1330nm 0.1076nm 116.6 。 121.7
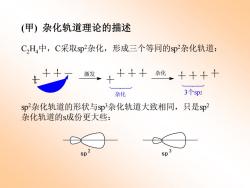
(甲)杂化轨道理论的描述 C2H4中,C采取sp杂化,形成三个等同的sp杂化轨道: 激发, 大+4子 杂化、十十十十 杂化 3个sp2 sp杂化轨道的形状与sp3杂化轨道大致相同,只是sp2 杂化轨道的s成份更大些: 9p2
(甲) 杂化轨道理论的描述 C2H4中,C采取sp2杂化,形成三个等同的sp2杂化轨道: 杂化 3个sp2 激发 杂化 sp2杂化轨道的形状与sp3杂化轨道大致相同,只是sp2 杂化轨道的s成份更大些: sp 3 sp 2
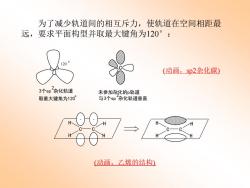
为了减少轨道间的相互斥力,使轨道在空间相距最 远,要求平面构型并取最大键角为120°: (动画,Sp2杂化碳) 3个sp杂化轨道 未参加杂化的p轨道 取最大键角为120 与3个sp杂化轨道垂直 (动画,乙烯的结构)
为了减少轨道间的相互斥力,使轨道在空间相距最 远,要求平面构型并取最大键角为120° : 120 。 C 3个sp 杂化轨道 2 取最大键角为120 。 未参加杂化的p轨道 与3个sp 杂化轨道 2 垂直 (动画,sp2杂化碳) H H H H C C H H H H C C (动画,乙烯的结构)

(乙)分子轨道理论的描述 分子轨道理论主要用来处理p电子。 乙烯分子中有两个未参加杂化的p轨道,这两个p轨道可 通过线性组合(加加减减)而形成两个分子轨道: 能量 Y2=1-2 Ψ1=1+2
(乙) 分子轨道理论的描述 分子轨道理论主要用来处理p电子。 乙烯分子中有两个未参加杂化的p轨道,这两个p轨道可 通过线性组合(加加减减)而形成两个分子轨道: p( ) p() 能量 * = − = + + + - -
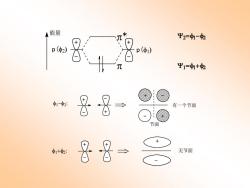
能量 平2=1-2 p(中1) Ψ1=+2 暑8 有一个节面 节面 &→ 无节面
p( ) p() 能量 * = − = + + + - - − : 节面 + + + + - - - - 有一个节面 +: + - 无节面 + + - -

分子轨道理论解释的结果与价键理论的结果相同, 最后形成的π键电子云为两块冬瓜形,分布在乙烯分子平 面的上、下两侧,与分子所在平面对称: 动画(乙烯的结构 其它烯烃分子中的C=C: CH3 C2H5 丙烯的结构 丁烯的结构
分子轨道理论解释的结果与价键理论的结果相同, 最后形成的π键电子云为两块冬瓜形,分布在乙烯分子平 面的上、下两侧,与分子所在平面对称: H H H H C C 动画(乙烯的结构) H H H C C CH3 H H H C C C2 H5 丙烯的结构 丁烯的结构 其它烯烃分子中的C=C:

小 结 π键的特性: ①π键不能自由旋转。 ②π键键能小,不如σ键牢固。 碳碳双键键能为611KJ/mol,碳碳单键键能为 347JK/mol. ∴.π键键能为611-347=264K/mol ③π键电子云流动性大,受核束缚小,易极化。 ∴π键易断裂、起化学反应。 国
小 结 π键的特性: ①π键不能自由旋转。 ②π键键能小,不如σ键牢固。 碳碳双键键能为611KJ/mol,碳碳单键键能为 347JK/mol, ∴π键键能为611-347=264K/mol ③π键电子云流动性大,受核束缚小,易极化。 ∴π键易断裂、起化学反应
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 沈阳药科大学:《有机化学》课程教学资源(PPT课件)第十二章 羧酸衍生物.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十九章 氨基酸、多肽、蛋白质和核酸 Amino Acids, Peptides and Nucleic acids.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第十一章 醛、酮、醌.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第六章 有机化合物的结构表征.ppt
- 中国科学技术大学:《有机化学》课程教学资源(PPT课件)第七章 芳香烃 Aromatic compounds.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十章 沉淀平衡 Precipitation-dissolution equilibrium.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十三章 氢和稀有气体 Hydrogen and rare gases.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第十七章 碳硅硼 Carborn Silicon and Boron.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第八章 水溶液 Water Solution.ppt
- 西昌学院:《无机化学》课程教学资源(PPT课件)第七章 化学动力学基础 Primary of Chemical Reaction Kinetics.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第十四章 氢 Hydrogen.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第五章 酸、碱和酸碱反应 Acid, base & acid-base reaction.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第九章 s区元素 s-Block Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十九章 配合物(配位化学基础知识).ppt
- 四川大学:《物理化学》课程教学资源(课件讲稿)第二章 多组分系统热力学.pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)第5章 糖类代谢.pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)第3章 核酸(nucleic acid).pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)实验指导书(共二十六个实验).pdf
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第四章 二烯烃和共轭体系.ppt
- 陕西科技大学:《有机化学》课程教学资源(PPT课件)第十八章 杂环化合物.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第二章 核酸的结构与功能.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第四章 三酸酸循环和氧化磷酸化.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第七章 含氮化合物代谢.ppt
- 上海交通大学:《生物化学》课程电子教案(PPT教学课件)第十章 氢离子代谢(酸碱代谢).ppt
- 山西医科大学:《生物化学》课程教学课件(讲稿)第2章 糖与糖复合物 Carbohydrate and Glycoconjugate.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第3章 脂类与复合脂 Lipids and Lipid Complex.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第5章 酶与其他生物催化剂 Enzymes and Other Biocatalysts.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第7章 糖代谢 Carbohydrate Metabolism.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第二篇 物质代谢与能量代谢 第9章 三羧酸循环 Tricarboxylic Acid Cycle.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第12章 氨基酸代谢 Metabolism of Amino Acids.pdf
- 山西医科大学:《生物化学》课程教学课件(讲稿)第13章 核苷酸代谢 The Nucleotide Metabolism.pdf
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律(9/9).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(06/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(09/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第一章 统计热力学(图片版,3/5).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(14/17).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(17/17,图片版).ppt
- 吉林大学:《物理化学》课程教学课件(PPT讲稿)第七章 化学动力学基础(04/17,图片版).ppt
