河南农业大学:《生物化学》课程教学课件(PPT讲稿)第八章 蛋白质的生物合成(2/2)

五.真核细胞蛋白质的生物合成 真核细胞中蛋白质合成的基本过程与原核细 胞中的相似,但真核细胞的蛋白质合成过 程中包括更多的蛋白质组分,并且有些步 骤更复杂。 ·(1)原核生物翻译与转录是偶联的,而真 核生物不存在这种偶联关系。 (2)核糖体更大。 ■(3)起始氨基酸和起始tRNA。 (4)起始信号
五.真核细胞蛋白质的生物合成 真核细胞中蛋白质合成的基本过程与原核细 胞中的相似,但真核细胞的蛋白质合成过 程中包括更多的蛋白质组分,并且有些步 骤更复杂。 ◼ (1)原核生物翻译与转录是偶联的,而真 核生物不存在这种偶联关系。 ◼ (2)核糖体更大。 ◼ (3)起始氨基酸和起始tRNA。 ◼ (4)起始信号
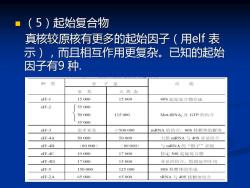
(5)起始复合物 真核较原核有更多的起始因子(用elf表 示),而且相互作用更复杂。已知的起始 因子有9种. 种类 分 子 量 功能 亚基 天然态 elF-1 15000 15000 40S起始复合物形成 elF-2 55000 50000 125000 Met-tRNA;及GTP的结合 35000 elF-3 很多亚基 ≥500000 mRNA的结合,8OS核糖体的解离 elF-4A 50000 50000 天然mRNA与4OS业基结合 elF-4B (80000) (80000) 与mRNA的“帽子”识别 elF-4C 19000 17000 稳定30S起始复合物 elF-4D 17000 15000 亚基的结合,啮链延伸作用 elF-5 150000 125000 80S核糖体的形成 elF-2A 65000 65000 tRNA与4OS核糖体结合
◼ (5)起始复合物 真核较原核有更多的起始因子(用elf 表 示),而且相互作用更复杂。已知的起始 因子有9 种

(6)延长因子和终止因子 真核生物中的延长因子EFIo和EFIBY与原 核生物的EF-Tu和EF-Fs是极相似的.EFlo- GTP使氨酰-tRNA进入核糖体的A位,而 EFIBy催化EFla-GDP和EFIo-GTP的相互 转变。 真核的EF2和原核的EF-G一样,作用于 GTP促进移位。 真核的终止信号只能被一种释放因子eRF 识别,其作用需要GTP
◼ (6)延长因子和终止因子 真核生物中的延长因子EFlα和EFlßγ与原 核生物的EF-Tu 和EF-Fs 是极相似的.EFlα- GTP 使氨酰-tRNA 进入核糖体的A 位,而 EFlßγ催化EFlα-GDP 和EFlα-GTP 的相互 转变。 真核的EF2 和原核的EF-G 一样,作用于 GTP 促进移位。 真核的终止信号只能被一种释放因子eRF 识别,其作用需要GTP

六.蛋白质合成的抑制剂 蛋白质合成的几乎每一步会被这种或另一种抗生素专一地 制,所以抗生素色成为研究蛋白质合成的有用工真。 嘌昤霉素.(puromycin)由链霉菌产生,是了解最清楚的 种师性抗生素。其结构写氨酰-tRNA的3端很相似此 熊与速留蟹不节谎它不参与从7 并且参与肽键的形成,产生肽基 嘌呤霉 移和窝自很快与肽的骏基末端结合,导致 草地终止多肽的合成。 四环素(tetracycline)通过明断核糖体的A位、抑制氨酰 tRNA的结合来抑制细菌币蛋白质的合成。 氨奏人hor兴ea的通界擴幕整蛊岂 浅粒体和叶绿体中)肽基的转移莱抑制蛋白质的合成; 无法影响真核生物胞质蛋白质的合成
六.蛋白质合成的抑制剂 蛋白质合成的几乎每一步会被这种或另一种抗生素专一地 抑制,所以抗生素已成为研究蛋白质合成的有用工具。 ◼ 嘌呤霉素(puromycin)由链霉菌产生,是了解最清楚的 一种抑制性抗生素。其结构与氨酰-tRNA的3ˊ端很相似,因此 能与核糖体的A位结合,并且参与肽键的形成,产生肽基 嘌呤霉素。嘌呤霉素只类似于tRNA的3ˊ端,它不参与从 核糖体的移位和分离,且很快与肽的羧基末端结合,导致 过早地终止多肽的合成。 ◼ 四环素(tetracycline)通过阻断核糖体的A位、抑制氨酰- tRNA的结合来抑制细菌中蛋白质的合成。 ◼ 氯霉素(chloramphenicol)通过阻断细菌核糖体中(以 及线粒体和叶绿体中)肽基的转移来抑制蛋白质的合成;它 无法影响真核生物胞质蛋白质的合成

■ 放线菌酮(cycloheximide)能抑制真核生物80S核糖体的肽酰基转 不抑制细菌70S核糖体(以及线粒体和叶绿体中)中的肽酰 基转移酶。 链霉素.(streptomycin)是一种碱性三糖。链霉素能与30S-亚基结 登从茜抑制自质的冷成年30S·链霉 不鲜委生的合本素年暴明 人 一种效率很低自很 威襲改变氨基既t公在忘即 与其对应的密码子配对的精确性和 细菌对链霉素的抗性是由于30S小亚基中桌一个肽链产生突变 之故。 红霉素(erythromycin)与50S大亚基结合 并阻断移位作用因而将肽 酰tRNA冻结在A位点上。 对红霉素产生抗性是由宇书0S大亚基中 一个蛋白质产生突变之故。 还有 些蛋白质合成的抑制剂对人体和其他哺乳动物是有害的。白喉 diphtheria toxin)可化真廷物延因子eE2年百喉蘇胺 饰军氨】残綦的ADP核基花 七作用而失适 .(ricn) 种剧毒的蓖麻籽 蛋白质 起23 S rRNA中 特定腺苷发 生去嘌岭作,使真核注物核糖体的60S亚基失去活性
◼ 放线菌酮(cycloheximide)能抑制真核生物80S核糖体的肽酰基转 移酶,而不抑制细菌70S核糖体(以及线粒体和叶绿体中)中的肽酰 基转移酶。 ◼ 链霉素(streptomycin)是一种碱性三糖。链霉素能与30S-亚基结 合从而抑制蛋白质的合成;此30S-链霉素复合体是一种效率很低且很 不稳定的起始解离而终止翻译的复合体。链霉素结合在30S亚基上时 亦能改变氨基酰-tRNA在A位点上与其对应的密码子配对的精确性和 效率。细菌对链霉素的抗性是由于30S小亚基中某一个肽链产生突变 之故。 ◼ 红霉素(erythromycin)与50S大亚基结合,并阻断移位作用因而将肽 酰-tRNA“冻结”在A位点上。对红霉素产生抗性是由于50S大亚基中 某一个蛋白质产生突变之故。 ◼ 还有一些蛋白质合成的抑制剂对人体和其他哺乳动物是有害的。白喉 毒素(diphtheria toxin)可催化真核生物延伸因子eEF2中白喉酰胺 (修饰的组氨酸)残基的ADP核糖基化作用而失活。蓖麻毒素(ricin) 是一种剧毒的蓖麻籽蛋白质,它会引起23S rRNA中一个特定腺苷发 生去嘌呤作用,使真核生物核糖体的60S亚基失去活性

七蛋白质合成后的加工 对于不同的蛋白质来说,加工过程有所不同,没 有 一 的模式,概括地说,可以有下列几种方式。 1.氨基未端和羧基末端的修饰 所有的多肽都是以N-甲酰甲硫氨酸(原核生物》 或甲硫氨酸(真核生物)开始的。但是,甲酰基 氢天单中硫氨酸殊} 及其他额外的氨基未 端和羧基耒端的一世残基最姿可能狡酶法除去 因此不存在于最后的功能性蛋白质中。 在多种真核蛋白中,其翻译后氨基末端残基的氨 基都要被乙酰花,羧基残基有时花被修筛
七.蛋白质合成后的加工 对于不同的蛋白质来说,加工过程有所不同,没 有统一的模式,概括地说,可以有下列几种方式。 1.氨基末端和羧基末端的修饰 ◼ 所有的多肽都是以N-甲酰甲硫氨酸(原核生物) 或甲硫氨酸(真核生物)开始的。但是,甲酰基、 氨基末端的甲硫氨酸残基以及其他额外的氨基末 端和羧基末端的一些残基最终可能被酶法除去, 因此不存在于最后的功能性蛋白质中。 ◼ 在多种真核蛋白中,其翻译后氨基末端残基的氨 基都要被乙酰化,羧基残基有时也被修饰

2.切除部分肽段 有些新合成的多肽链要在专 性的蛋白酶的作用下切除部分 肽段才能具有活性。例如酶原 要切除部分肽段才能形成有活 ads in tansporung 性的酶。 After membrane transport, 还有些肽链的N-末端存在着 品 15~30个氨基酸的一段顺序 Disultide bonds form 其功能与将此蛋白质多肽链输 送到细胞的特定部位(细胞器)有 关,所以称为信号肽。在肽链 被输送到某特定部位后,此信 号肽即被切除
2.切除部分肽段 有些新合成的多肽链要在专一 性的蛋白酶的作用下切除部分 肽段才能具有活性。例如酶原 要切除部分肽段才能形成有活 性的酶。 还有些肽链的N-末端存在着 15~30个氨基酸的一段顺序, 其功能与将此蛋白质多肽链输 送到细胞的特定部位(细胞器)有 关,所以称为信号肽。在肽链 被输送到某特定部位后,此信 号肽即被切除

3.氨基酸残基的修饰 在蛋白质合成中多种氨基酸均可发生修饰,包括羟基化、糖基 化、磷酸化、酰基化、羧化作用、甲基化。 (1)羟基化:肽链中某些氨基酸的侧链被修饰,这都是在翻译后 的加工过程中被专一的酶催化而形成的。例如脯氨酸被羟基化 生成羟脯氨酸,胶原蛋白在合成后,其中的某些脯氨酸和赖氨 酸残基发生羟化。脯氨酸的羟化有助于胶原蛋白螺旋的稳定。 (2)糖基化:在多肽链合成过程中或在合成之后常以共价键与单 糖或寡糖侧链连接,生成糖蛋白。这些糖可连接在天冬酰胺的 酰胺上(N-连接寡糖)或连接在丝氨酸、苏氨酸或羟赖氨酸的羟 基上(O-连接寡糖),糖基化是多种多样的,可以在同一条肽链 上的同一位点连接上不同的寡糖,也可以在不同位点上连接上 寡糖。糖基化是在酶催化反应下进行的。糖蛋白是一类重要的 蛋白,许多膜蛋白和分泌蛋白均是糖蛋白
3.氨基酸残基的修饰 在蛋白质合成中多种氨基酸均可发生修饰,包括羟基化、糖基 化、磷酸化、酰基化、羧化作用、甲基化。 (1)羟基化:肽链中某些氨基酸的侧链被修饰,这都是在翻译后 的加工过程中被专一的酶催化而形成的。例如脯氨酸被羟基化 生成羟脯氨酸,胶原蛋白在合成后,其中的某些脯氨酸和赖氨 酸残基发生羟化。脯氨酸的羟化有助于胶原蛋白螺旋的稳定。 (2)糖基化:在多肽链合成过程中或在合成之后常以共价键与单 糖或寡糖侧链连接,生成糖蛋白。这些糖可连接在天冬酰胺的 酰胺上(N-连接寡糖)或连接在丝氨酸、苏氨酸或羟赖氨酸的羟 基上(O-连接寡糖),糖基化是多种多样的,可以在同一条肽链 上的同一位点连接上不同的寡糖,也可以在不同位点上连接上 寡糖。糖基化是在酶催化反应下进行的。糖蛋白是一类重要的 蛋白,许多膜蛋白和分泌蛋白均是糖蛋白

(3)磷酸化:磷酸化发生在翻译后,由各种蛋白质激酶催 化,将磷酸基团连接于丝氨酸、苏复酸和酪氨酸的羟基上。 在磷酸酯酶的作用则发生脱磷酸作用。 (4)酰基化:蛋白质的乙酰化普遍存在于原核生物和真核 生物中。乙酰化有两个类型:一类是由结合于核糖体的乙 酰基转移酶将乙酰-CoA的乙酰基转移至正在合成的多肽 链上,当将N-端的甲硫氨酸除去后,便乙酰化;另一类型 是在翻译后由细胞质的酶催化发生乙酰化。此外,细胞核 内的组蛋白的内部赖氨酸也可以乙酰化。 (5)羧化作用:一些蛋白质的谷氨酸和天冬氨酸可发生羧 化作用。例如,血液凝固蛋白酶原的谷氨酸在翻译后羧化 成y羧基谷复酸,后者可以与Ca2+螯合。这依赖于维生素 K的羧化酶的催化作用。 (6)甲基化:在一些蛋白质中赖氨酸被甲基化。如肌肉蛋 白和细胞色素c中含有一甲二甲基赖氨酸。大多数生物的 钙调蛋白含有三甲基赖氨酸。有些蛋白质中的一些谷氨酸 链羧基也发生甲基化
(3)磷酸化:磷酸化发生在翻译后,由各种蛋白质激酶催 化,将磷酸基团连接于丝氨酸、苏氨酸和酪氨酸的羟基上。 在磷酸酯酶的作用则发生脱磷酸作用。 (4)酰基化:蛋白质的乙酰化普遍存在于原核生物和真核 生物中。乙酰化有两个类型:一类是由结合于核糖体的乙 酰基转移酶将乙酰-CoA 的乙酰基转移至正在合成的多肽 链上,当将N-端的甲硫氨酸除去后,便乙酰化;另一类型 是在翻译后由细胞质的酶催化发生乙酰化。此外,细胞核 内的组蛋白的内部赖氨酸也可以乙酰化。 (5)羧化作用:一些蛋白质的谷氨酸和天冬氨酸可发生羧 化作用。例如,血液凝固蛋白酶原的谷氨酸在翻译后羧化 成γ-羧基谷氨酸,后者可以与Ca2+螯合。这依赖于维生素 K 的羧化酶的催化作用。 (6)甲基化:在一些蛋白质中赖氨酸被甲基化。如肌肉蛋 白和细胞色素c 中含有一甲二甲基赖氨酸。大多数生物的 钙调蛋白含有三甲基赖氨酸。有些蛋白质中的一些谷氨酸 链羧基也发生甲基化

.二硫键的形成 肽链内或两条肽链间的二硫键是在肽链形成后 SH基被氧化而形成的。二硫键在形成蛋白质的空 间结构中起着重要作用,有助于保护蛋白质分子 的天然构象。 5.基之间、亚基与辅基之间的聚合 具有四级结构的蛋白质由几个亚基组成,因此必 须经过亚基之间的聚合过程才能形成具有特定构 象和生物功能的蛋白质。对于结合蛋白来说,含 有辅基成分,所以也要与辅基部分结合后才能具 有生物功能
4.二硫键的形成 肽链内或两条肽链间的二硫键是在肽链形成后- SH 基被氧化而形成的。二硫键在形成蛋白质的空 间结构中起着重要作用,有助于保护蛋白质分子 的天然构象。 5.亚基之间、亚基与辅基之间的聚合 具有四级结构的蛋白质由几个亚基组成,因此必 须经过亚基之间的聚合过程才能形成具有特定构 象和生物功能的蛋白质。对于结合蛋白来说,含 有辅基成分,所以也要与辅基部分结合后才能具 有生物功能
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第八章 蛋白质的生物合成(1/2).ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第七章 核酸的生物合成.ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第六章 含氮化合物代谢.ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第四章 糖类代谢.ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第三章 酶学.ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第二章 蛋白质化学.ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)生物化学绪论.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(基础生物化学)第十章 生物膜.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(基础生物化学)第九章 物质代谢的调控.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(基础生物化学)第八章 蛋白质的生物合成.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(基础生物化学)第七章 核酸的生物合成.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(基础生物化学)第六章 含氮化合物的代谢.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(基础生物化学)第四章 糖类代谢.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(基础生物化学)第三章 酶 Enzyme.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(基础生物化学)第二章 蛋白质.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(基础生物化学)第一章 核酸化学.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(基础生物化学)绪论 Biochemistry(主讲:陈新建).ppt
- 河南农业大学:《生物化学》课程PPT教学课件(本科双语教学)第十章 生物膜 Mechanism of Enzyme Action.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(本科双语教学)第九章 代谢调节 Specificity Is the Result of Molecular Recognition.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(本科双语教学)第五章 脂类代谢 Lipid.ppt
- 河南农业大学:《生物化学》课程教学课件(PPT讲稿)第九章 代谢调节.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第一章 绪论 ORGANIC CHEMISTRY(主讲:杨爱萍).ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第三章 不饱和脂肪烃.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第五章 旋光异构体.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第六章 卤代烃.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第七章 醇、酚、醚.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第八章 醛、酮、醌.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第九章 羧酸、羧酸衍生物和取代酸.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十章 含氮有机化合物.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十二章 杂环化合物(heterocyclic compound).ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十三章 油脂和类脂.ppt
- 青岛农业大学(莱阳农学院):《有机化学》课程教学资源(PPT课件)第十四章 糖类化合物.ppt
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)实验指导书(共二十六个实验).pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)第3章 核酸(nucleic acid).pdf
- 沈阳农业大学:《基础生物化学》课程教学资源(教材讲义)第5章 糖类代谢.pdf
- 四川大学:《物理化学》课程教学资源(课件讲稿)第二章 多组分系统热力学.pdf
- 福州大学:《大学基础化学》课程教学课件(PPT讲稿)第十九章 配合物(配位化学基础知识).ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and Periodic Table of Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第九章 s区元素 s-Block Elements.ppt
- 西北大学:《普通化学》课程教学资源(PPT课件)第五章 酸、碱和酸碱反应 Acid, base & acid-base reaction.ppt
