信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第6章 络合滴定法

第6章络合滴定法 。6.1分析化学中的常见络合物 。6.2络合物的平衡常数 。6.3副反应系数和条件稳定常数 。6.4络合滴定法的基本原理 。6.5准确滴定与分别滴定判别式 。6.6络合滴定中酸度的控制 o6.7提高络合滴定选择性的途径 。6.8络合滴定的方式及应用
1 第6章 络合滴定法 6.1 分析化学中的常见络合物 6.2 络合物的平衡常数 6.3 副反应系数和条件稳定常数 6.4 络合滴定法的基本原理 6.5 准确滴定与分别滴定判别式 6.6 络合滴定中酸度的控制 6.7 提高络合滴定选择性的途径 6.8 络合滴定的方式及应用

概述 0络合滴定: 利用络合反应进行滴定分析的方法,称为配位滴定 法。 路易斯(Lewis.)酸碱反应 路易斯酸:凡能接受电子对的物质称之酸 (如金属阳离子Fe3+、Zn2+、A3+); 路易斯碱:凡能给出电子对的物质称之碱 (如含O、N、S、卤素等元素的物质)。 例如:用AgNO3溶液滴定氰化物
概述 络合滴定: 利用络合反应进行滴定分析的方法,称为配位滴定 法。 路易斯(Lewis)酸碱反应 路易斯酸:凡能接受电子对的物质称之酸 (如金属阳离子Fe3+、Zn2+、Al3+); 路易斯碱:凡能给出电子对的物质称之碱 (如含O、N、S、卤素等元素的物质)。 例如:用AgNO3溶液滴定氰化物 2

虽然配位反应很多,但并非都可用以进行配位滴定,只有 满足下列条件的配位反应,才能用于配位滴定。 。1.配位反应必须完全,即配合物有足够大的稳定常数; 。2.在一定反应条件下,只形成一种配位数的配合物; 。3.配位反应速度要快; 。4.有适当的方法确定反应的等量点。 3
虽然配位反应很多,但并非都可用以进行配位滴定,只有 满足下列条件的配位反应,才能用于配位滴定。 1.配位反应必须完全,即配合物有足够大的稳定常数; 2.在一定反应条件下,只形成一种配位数的配合物; 3.配位反应速度要快; 4.有适当的方法确定反应的等量点。 3

本章的重难点: 复杂体系的平衡处理方法—副反应系数和条件稳 定常数gK的计算。 本章学习要求: (1)掌握处理各种较复杂络合平衡体系的方法,并会计 算副反应系数α、条件稳定常数lgK'及各型体的问; (2)理解和掌握络合滴定原理,并能解决一般问题
本章的重难点: 复杂体系的平衡处理方法——副反应系数α和条件稳 定常数lgK’的计算。 本章学习要求: (1)掌握处理各种较复杂络合平衡体系的方法,并会计 算副反应系数α、条件稳定常数lgK’及各型体的[i] ; (2)理解和掌握络合滴定原理,并能解决一般问题。 4
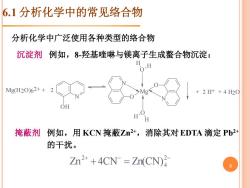
6.1分析化学中的常见络合物 分析化学中广泛使用各种类型的络合物 沉淀剂例如,8羟基喹啉与镁离子生成螯合物沉淀: Mg(H20)62++2 +2H++420 OH H 掩蔽剂 例如,用KCN掩蔽Zn2+,消除其对EDTA滴定Pb2+ 的干扰。 Zn2 +4CN Zn(CN)
沉淀剂 例如,8-羟基喹啉与镁离子生成螯合物沉淀: Mg(H2O )6 2+ + N O H 2 N O N O Mg O H H O H H + 2 H+ + 4 H2O 掩蔽剂 例如,用 KCN 掩蔽Zn2+,消除其对EDTA 滴定 Pb2+ 的干扰。 + − − + = 2 4 2 Zn 4CN Zn(CN) 分析化学中广泛使用各种类型的络合物 6.1 分析化学中的常见络合物 5
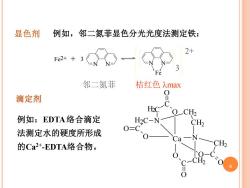
显色剂 例如,邻二氮菲显色分光光度法测定铁: 邻二氮菲 桔红色max 滴定剂 HC OCH2 例如:EDTA络合滴定 H2C-N CH2 法测定水的硬度所形成 O=C Ca 的Ca2+-EDTA络合物。 CH2
3 Fe2+ 3 N N + N N Fe 2+ 邻二氮菲 桔红色 max 显色剂 例如,邻二氮菲显色分光光度法测定铁: 滴定剂 例如:EDTA 络合滴定 法测定水的硬度所形成 的Ca2+ -EDTA络合物。 C C N C C O O O O CH2 CH2 CH2 O O C C CH2 N O O Ca H2 H2 6

分析化学中的络合物 简单配体络合物 螯合物 多核络合物 H2C Cu(NH3* OH H2C-N [(H2O)4Fe Fe(H2O)4]4 CH2 OH O=C、 Ca-N CH2 fo-C CH2 0
分析化学中的络合物 简单配体络合物 2+ 3 4 Cu(NH ) 螯合物 C C N C C O O O O CH2 CH2 CH2 O O C C CH2 N O O Ca H2 H2 多核络合物 [(H2O)4Fe OH OH Fe(H2O)4] 4+ 7

6.1.1简单络合物(无机络合物) 由中心离子和单基配体形成.如AF,3,Cu(NH)42+等。 无机络合剂:F,NH3,SCN,CN,CI, NH3:Cu2+、Co2+、Ni2+、Zn2+、Ag*、Cd2+ CN-:Cu2+、Co2+、Ni2+、Zn2+、Ag*、Cd2+、 Hg2+、Fe2+、Fe3+ 0H-:Cu2+、Co2+、Ni2+、Zn2+、Ag、Cd2+、 Fe2+、Fe3+、Bi3+、AI3+ F-:A3+、Fe3+ H3N NH3 CI-:Ag*、Hg2+ Cu2 HgN NH3
6.1.1 简单络合物(无机络合物) 由中心离子和单基配体形成.如AlF6 3- ,Cu(NH3 )4 2+等。 无机络合剂:F - , NH3 , SCN- , CN- , Cl- , Cu NH3 NH3 H3N H3N 2+ NH3 : Cu2+ 、Co2+ 、Ni2+ 、Zn2+ 、Ag+ 、Cd2+ CN-: Cu2+ 、Co2+ 、Ni2+ 、Zn2+ 、Ag+ 、Cd2+ 、 Hg2+ 、Fe2+ 、Fe3+ OH- : Cu2+ 、Co2+ 、Ni2+ 、Zn2+ 、Ag+ 、Cd2+ 、 Fe2+ 、Fe3+ 、Bi3+ 、Al3+ F- : Al3+ 、Fe3+ Cl- : Ag+ 、Hg2+ 8

缺点:1)不稳定 2)存在逐级络合现象,且逐级离解常数一般较为接近。 3)选择性差 作用:掩蔽剂,显色剂和指示剂, 作为滴定剂的只有氰量法(CN)和汞量法(Hg2+)。 9
缺点:1)不稳定 2)存在逐级络合现象,且逐级离解常数一般较为接近。 3)选择性差 作用:掩蔽剂,显色剂和指示剂, 作为滴定剂的只有氰量法(CN-)和汞量法(Hg2+)。 9

()汞量法:测定C和SCN o滴定剂:Hg(NO3)2或Hg(C1O4)2 。指示剂:二苯胺基脲 Hg2++2CI 离解度小,称拟盐或假盐 Hg2++2SCN-g(SCN)2 过量Hg2+与指示剂呈蓝紫色螯合物 也可用KSCN标准溶液滴定Hg2+,Fe3+作指示剂, SCN-与Fe3+呈橙红色即达终点 10
(1)汞量法:测定Cl-和SCN- 滴定剂:Hg(NO3 )2或Hg(ClO4 )2 指示剂:二苯胺基脲 离解度小,称拟盐或假盐 Hg2++2Cl- HgCl2 Hg2++2SCN- Hg(SCN)2 过量Hg2+与指示剂呈蓝紫色螯合物 也可用KSCN标准溶液滴定Hg2+ ,Fe3+作指示剂, SCN-与Fe3+呈橙红色即达终点 10
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第5章 酸碱滴定法.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第3章 分析化学中的误差与数据处理.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第2章 分析试样的采集与制备.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第1章 概论.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十二章 铁系元素和铂系元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十一章 铬副族元素和锰副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十章 钛副族元素和钒副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十九章 铜副族元素和锌副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十八章 氢和稀有气体.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十七章 卤素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十六章 氧族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十五章 氮族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十四章 碳族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十三章 硼族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十二章 碱金属和碱土金属.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十一章 配位化学基础.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十章 氧化还原反应.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第六章 分子结构和共价键理论.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第九章 沉淀溶解平衡.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第八章 酸碱解离平衡.pptx
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第7章 氧化还原滴定法 Oxidation-Reduction Titration Redox titration.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第8章 沉淀滴定法(Precipitation titrations).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第9章 重量分析法 Gravimetry(Gravimetric Analysis).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第10章 吸光光度法(Absorption Photometry).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第11章 分析化学中常用的分离和富集方法.pptx
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第二章 滴定分析概论.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第三章 酸碱滴定.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第四章 非水酸碱滴定法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第五章 误差与分析数据的处理.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第七章 氧化还原滴定法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第七章 重量分析法、第八章 沉淀滴定与重量分析.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第六章 配位滴定法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十章 电位法和永停滴定法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十四章 紫外可见分光光度法(2/3)第三节 基本原理、第四节 紫外分光光度计.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十四章 紫外可见分光光度法(1/3)第一节 光学分析概论、第二节 紫外-可见吸收光谱.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(1/5)第一节 概述、第二节 红外分光光度法基本原理(1/2).ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(3/5)第二节 红外分光光度法基本原理(2/2).ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(3/5)第四节 各种化合物的典型光谱(1/2).ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(4/5)第四节 各种化合物的典型光谱(2/2).ppt
