信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十五章 氮族元素

第十五章 氮族元素 §15-1氮族元素的通性 ·§15-2氮和它的化合物 ● §15-3磷和它的化合物 。§15-4砷、锑、秘
第十五章 氮族元素 ⚫ §15-1 氮族元素的通性 ⚫ §15-2 氮和它的化合物 ⚫ §15-3 磷和它的化合物 ⚫ §15-4 砷、锑、铋

15-1氮族元素的通性 基本性质 N As Sb Bi 价电子构型 ns2np3 主要 3-1,0, -3,0, 3,0, 0,+3,+5 0,+3,+5 氧化数 +1~+5 +1,+3,+5 +3,+5 小 大 I 大 小 电负性 3.04 2.19 2.18 2.05 2.02 EA1/kJ.mot 58< 75 58 59 33 B.E.(E-E) 160< 209 /kJ.moF1 N的EA和B.E.(E-E)“反常”,原因似F、O,反映第二周期元素的特殊性
15-1 氮族元素的通性 基本性质 N P As Sb Bi 价电子构型 ns2np3 主要 氧化数 -3~ -1,0, +1~ +5 -3, 0, +1,+3,+5 -3,0, +3,+5 0,+3,+5 0,+3,+5 r 小 大 I1 大 小 电负性 3.04 2.19 2.18 2.05 2.02 EA1 /kJ.mol- 1 58 < 75 58 59 33 B.E.(E-E) /kJ.mol-1 160 < 209 N的EA1和B.E. (E-E) “反常”,原因似F 、O,反映第二周期元素的特殊性

P(四、As(四、Sb(⑩、Bi(四 稳定性增大 P(V)、As(V)、Sb(V)、Bi( 稳定性增大 第四、第六周期高价态不稳定、强氧化性。 (次周期性、6s2惰性电子对效应) -2 -2 +1 +1 N2H4 P2H4 N2O I H3P02 Li,N、Mg3N2、NaP遇水强烈水解成NH3、PH3
稳定性增大 第四、第六周期高价态不稳定、强氧化性。 (次周期性、6s2惰性电子对效应) -2 -2 +1 +1 N2H4 P2H4 N2O H3PO2 Li3N、Mg3N2、Na3P遇水强烈水解成NH3、PH3。 P(III)、 As (III)、 Sb (III)、 Bi (III) 稳定性增大 P(V)、As (V)、 Sb (V)、 Bi (V)
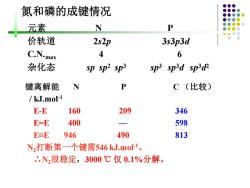
氮和磷的成键情况 元素 N P 价轨道 2s2p 3s3p3d C.N.max 4 6 杂化态 sp sp2 sp3 sp3 sped sp3d 键离解能 N P C(比较) /kJ.mol-1 E-E 160 209 346 E=E 400 一 598 E=E 946 490 813 N2打断第一个键需546kJ.mo1。 '.N,很稳定,3000℃仅0.1%分解
氮和磷的成键情况 元素 N P 价轨道 2s2p 3s3p3d C.N.max 4 6 杂化态 sp sp2 sp3 sp3 sp3d sp3d 2 键离解能 N P C (比较) / kJ.mol-1 E-E 160 209 346 E=E 400 — 598 E≡E 946 490 813 N2打断第一个键需546 kJ.mol-1 。 ∴N2很稳定,3000 ℃ 仅 0.1%分解

15-2 氮和它的化合物 2-1、氮 1.物理性质 氮气是无色、无嗅、无味的气体。微溶于水。m.p.63K, b.p.77K,临界温度126K(高于此温度,单靠增大压力无法 使之液化)
15-2 氮和它的化合物 2-1、氮 1.物理性质 氮气是无色、无嗅、无味的气体。微溶于水。 m.p. 63 K, b.p. 77 K,临界温度126 K(高于此温度,单靠增大压力无法 使之液化)

2.分子结构 (1) 价键理论(VB) N 2s2 2px 2py 2p: lσπ|z N 2s2 2px 2py 2p. 即:N≡N:1o+2元 (2)分子轨道理论MO) N2KK(o2)2(C2s)2(2y,及'(C)2] 键级=(8-2)/2=3 Li~N2 E(O2px)>E(2p) 对比:O2、F2、Nez:E(o2)<E(p
2.分子结构 (1) 价键理论(VB) N 2s2 2px 1 2py 1 2pz 1 | | | N 2s2 2px 1 2py 1 2pz 1 即 : N ≡ N : 1 + 2 (2)分子轨道理论(MO) N2 [KK(2s) 2 (2s * ) 2 (2py , 2pz) 4 (2px) 2 ] 键级 =(8-2)/ 2 = 3 Li2 ~ N2 : E (2px) > E (2p) 对比 :O2、F2 、Ne2 : E (2px) < E (2p)

第二周期元素双原子分子分子轨道能级次序 nipin o'm +十什什 02p Li2 (Be)B2 C2 N2 02 F2
第二周期元素双原子分子分子轨道能级次序

3.化学性质 室温下,N,很不活泼,在化学反应中常作保护气体。 高温下,NN键断开,N电负性大→N,显出化学活泼 性一氧化还原性和配位性质。 改丛 催化剂,△ 例2:日D Mg △ 例3:Ba+N) 相应的氮化物 Al Ti 6Li+N2→2LiN
3. 化学性质 室温下, N2很不活泼,在化学反应中常作保护气体。 高温下,N≡N键断开,N电负性大 → N2显出化学活泼 性—氧化 还原性和配位性质。 例1:N2+O2 放电⎯→2NO Mg 例3: Ba + N2 相应的氮化物 Al Ti N2 (g)+3H2 (g) 2NH3 (g) 催化剂, ∆ 例2: ∆
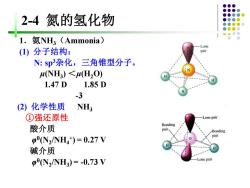
2-4氮的氢化物 氨NH3(Ammonia) Lone ()分子结构: N:sp杂化,三角锥型分子。 (NH3)<H,O) 1.47D 1.85D -3 (2)化学性质 NH; ①强还原性 Lone pair 酸介质 Bonding pair Bonding pN2/NH4t)=0.27V 碱介质 p(N2/NH3)=-0.73V -Lone pair
2-4 氮的氢化物 1.氨NH3(Ammonia) (1) 分子结构: N: sp3杂化,三角锥型分子。 μ(NH3 ) <μ(H2O) 1.47 D 1.85 D -3 (2) 化学性质 NH3 ①强还原性 酸介质 φ (N2 /NH4 + ) = 0.27 V 碱介质 φ (N2 /NH3 ) = -0.73 V

4上E工2尘五= 例: 4上6 2NH3 (g)+3Cl2 (g)=N2 (g)+6 HCI 2NH3(aq)+3H202(aq)=N2(g)+6H20 ②Lewis碱性(络合作用) AgCI(s)+2 NH3(aq)=[Ag(NH3)]++CI(aq) (Cu2+、C02+、Co3+、Ni2+.) BF3 NH3= F3B←-NH3 Lewis acid Lewis base 酸碱加合物 H2O NH3=NH,++OH 氨的水溶液呈弱碱性
2NH3 (g) + 3Cl2 (g) = N2 (g) + 6 HCl 2NH3 (aq) + 3H2O2 (aq)= N2 (g) + 6H2O 2NH3(g)+3CuO(s) ⎯→ 3Cu(s) +N2(g)+H2O(g) ② Lewis 碱性(络合作用) AgCl (s) + 2 NH3 (aq) = [Ag(NH3 )2 ] + + Cl- (aq) (Cu2+ 、Co2+ 、Co3+ 、Ni2+ .) BF3 + NH3 = F3B←NH3 Lewis acid Lewis base 酸碱加合物 H2O + NH3 = NH4 + + OH- 例: 4NH5O( ) 4NO6HO 4NH3O() 2N6HO 2 Pt 3 2 3 2 2 2 + ⎯→+ + →+ 空气 纯 氨的水溶液呈弱碱性
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十四章 碳族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十三章 硼族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十二章 碱金属和碱土金属.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十一章 配位化学基础.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十章 氧化还原反应.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第六章 分子结构和共价键理论.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第九章 沉淀溶解平衡.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第八章 酸碱解离平衡.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第七章 晶体结构.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第五章 原子结构和元素周期律.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第四章 化学平衡.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第三章 化学反应速率.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二章 化学热力学基础.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第一章 化学基础知识.pptx
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第九章 红外光谱分析 第三节 红外光谱与分子结构.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第十节 薄板与纸层析.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第四节 分离条件选择.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第五节 定性定量方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第二节 紫外可见分光光度法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第三章 滴定分析 第一节 滴定分析法概述.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十六章 氧族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十七章 卤素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十八章 氢和稀有气体.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十九章 铜副族元素和锌副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十章 钛副族元素和钒副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十一章 铬副族元素和锰副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十二章 铁系元素和铂系元素.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第1章 概论.pptx
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第2章 分析试样的采集与制备.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第3章 分析化学中的误差与数据处理.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第5章 酸碱滴定法.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第6章 络合滴定法.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第7章 氧化还原滴定法 Oxidation-Reduction Titration Redox titration.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第8章 沉淀滴定法(Precipitation titrations).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第9章 重量分析法 Gravimetry(Gravimetric Analysis).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第10章 吸光光度法(Absorption Photometry).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第11章 分析化学中常用的分离和富集方法.pptx
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第二章 滴定分析概论.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第三章 酸碱滴定.ppt
