信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第11章 分析化学中常用的分离和富集方法

第11章分析化学中常用的分离富集方法 11.1 概述 11.2 气态分离法 11.3 沉淀与过滤分离 11.4萃取分离法 11.5离子交换分离法 11.6色谱分离 11.7 电分离法 11.8气浮分离法 11.9膜分离
第11章分析化学中常用的分离富集方法 11.1 概述 11.2 气态分离法 11.3 沉淀与过滤分离 11.4 萃取分离法 11.5 离子交换分离法 11.6 色谱分离 11.7 电分离法 11.8 气浮分离法 11.9 膜分离

11.1概述 分离 富集 分离后所得待测组分质量 回收率=试样中原有待测组分质量 -×100% 待测组分回收率用来衡量分离富集效果,对回收率的 要求随待测组分含量的不同而不同。 质量分数>1% 回收率>99.9% 质量分数为0.01%-1% 回收率>99% 质量分数<0.01% 回收率90%-95%
11.1 概述 分离 富集 回收率= ×100% 分离后所得待测组分质量 试样中原有待测组分质量 待测组分回收率用来衡量分离富集效果,对回收率的 要求随待测组分含量的不同而不同。 质量分数>1% 回收率>99.9% 质量分数为0.01%-1% 回收率>99% 质量分数<0.01% 回收率 90%-95%

11.2气态分离法 液体或固体试样中被分离组分以气体的形式分离出去, 包括蒸发、蒸馏、升华、气体发生等方法。 11.2.1挥发 挥发:固体或液体全部或部分转化为气体的过程。 具有气态新化合物的生成和挥发,成为化学挥发法。 注意:挥发不包含蒸发和升华,后两者是固体和液 体的直接气化,无化学反应和新物质的生成
11.2 气态分离法 11.2.1 挥发 挥发:固体或液体全部或部分转化为气体的过程。 具有气态新化合物的生成和挥发,成为化学挥发法。 注意:挥发不包含蒸发和升华,后两者是固体和液 体的直接气化,无化学反应和新物质的生成。 液体或固体试样中被分离组分以气体的形式分离出去, 包括蒸发、蒸馏、升华、气体发生等方法

产生气体的方法: A)直接加热,如NHNO,分解为N和H,O; B)强酸置换弱酸或强碱置换弱碱,如HCl与CaCO,反 应放出CO,; C)氧化,如在空气中灼烧硫化物放出S02: D) 还原,如氢气还原砷酸盐转为AsH3: E) 卤化,如飞硅(Si证4)、飞铬(CrO,Cl)等 11.2.2升华 升华:固体物质不经过液态就变成气态的过程 如碘、干冰、砷、硫磺等
升华: 固体物质不经过液态就变成气态的过程 如碘、干冰、砷、硫磺等 产生气体的方法: A)直接加热,如NH4NO2分解为N2和H2O; B)强酸置换弱酸或强碱置换弱碱,如HCl与CaCO3反 应放出CO2; C)氧化,如在空气中灼烧硫化物放出SO2; D)还原,如氢气还原砷酸盐转为AsH3; E)卤化,如飞硅(SiF4)、飞铬(CrO2Cl2 )等 11.2.2 升华

11.2.3蒸馏 蒸馏的原理基于气液平衡,在一定温度下,将较易挥 发的组分从固体或液体中成为气体被富集分离。 a常压蒸馏 许多酸或酯的沸点较低,可将某些元素转变成这类 物质蒸馏分离。如硼酸酯 b水蒸气蒸馏 如果一溶液的组成在它的沸点分解,必须减压蒸馏 或水蒸汽蒸馏。水蒸气蒸馏的那些化合物须不与水混溶 c减压和真空蒸馏 在低于大气压以下的蒸馏称为减压和真空蒸馏,用 于分离易分解的化合物,也可用于分离Cd和Hg等贵属
a 常压蒸馏 许多酸或酯的沸点较低,可将某些元素转变成这类 物质蒸馏分离。如硼酸酯 b 水蒸气蒸馏 如果一溶液的组成在它的沸点分解,必须减压蒸馏 或水蒸汽蒸馏。水蒸气蒸馏的那些化合物须不与水混溶 c 减压和真空蒸馏 在低于大气压以下的蒸馏称为减压和真空蒸馏,用 于分离易分解的化合物,也可用于分离Cd和Hg等贵属。 11.2.3 蒸馏 蒸馏的原理基于气液平衡,在一定温度下,将较易挥 发的组分从固体或液体中成为气体被富集分离

d共沸蒸馏 例如无水乙醇的制备,水和乙醇形成共沸物(95%乙醇), b.p.=78.15℃加入苯形成另一共沸物(苯74%,乙醇18.5%,水7.5%) b.p.=65℃在65℃蒸馏,除去水,在68℃苯和乙醇形成共沸物(苯 67.6%,乙醇32.4%)在68℃蒸馏直到温度升高,在78.5℃能获得纯 乙醇。 e萃取蒸馏(extractive distillation) 例由氢化苯(80.1℃)生成环己烷(80.8℃)时,一般的蒸馏不能 分离,加入苯胺(184℃)与苯形成络合物,在比苯高的温度沸腾 ,从而分离环己烷
例如无水乙醇的制备,水和乙醇形成共沸物((95%乙醇), b.p.=78.15℃加入苯形成另一共沸物(苯74%,乙醇18.5%,水7.5%) b.p.=65℃在65℃蒸馏, 除去水, 在68℃苯和乙醇形成共沸物(苯 67.6%,乙醇32.4%)在68℃蒸馏直到温度升高,在78.5℃能获得纯 乙醇。 d 共沸蒸馏 e 萃取蒸馏(extractive distillation) 例由氢化苯(80.1℃)生成环己烷(80.8℃)时,一般的蒸馏不能 分离,加入苯胺(184℃)与苯形成络合物,在比苯高的温度沸腾 ,从而分离环己烷

11.3沉淀分离 11.3.1常量组分的沉淀分离 A)无机物沉淀 氢氧化物沉淀 NaOH法 可使两性氢氧化物(Al,Ga,Zn,Be,CrO2,Mo,W,GeO,2,V, Nb,Ta,Sn,Pb等)溶解而与其它氢氧化物(Cu,HgFe,Co,Ni,Ti.Zr, HE,Th,RE等)沉淀分离 氨水铵盐缓冲法 控制pH值8~I0,使高价离子沉淀(AL,Sn等),与一、二价离 子(碱土金属,一、二副族)分离 ZnO悬浊液法 控制pH=6,定量沉淀pH6以下能沉淀完全的金属离子 有机碱法 六次甲基四胺,吡啶,苯胺等有机碱与其共轭酸组成溶液 控制溶液的pH值
11.3 沉淀分离 11.3.1 常量组分的沉淀分离 氢氧化物沉淀 NaOH法 可使两性氢氧化物(Al,Ga,Zn,Be,CrO2 ,Mo,W,GeO3 2- , V, Nb,Ta ,Sn,Pb等)溶解而与其它氢氧化物(Cu, Hg, Fe, Co, Ni, Ti. Zr, Hf, Th, RE等)沉淀分离 氨水-铵盐缓冲法 控制pH值8~10,使高价离子沉淀(Al, Sn等), 与一、二价离 子(碱土金属,一、二副族)分离 ZnO悬浊液法 控制pH=6,定量沉淀pH6以下能沉淀完全的金属离子 有机碱法 六次甲基四胺,吡啶,苯胺等有机碱与其共轭酸组成溶液 控制溶液的pH值 A)无机物沉淀

▣硫酸盐沉淀 是消除大量Ba2+,Pb2+,Sr2+和疏酸根干扰的主要方法。 硫酸作沉淀剂,浓度不能太高,因易形成MHSO,盐加 大溶解度。沉淀碱土金属和Pb+,CaSO4溶解度大,加入 乙醇降低溶解度。 ▣ 卤化物沉淀 应用最多的是氟化稀土和各类卤化银沉淀 如:冰晶石法沉淀铝 在pH=4.5Al(I)与NaF生成(NaAIF6)沉淀,分离AII),与 Fe(II),Cr(I),NiI),V(V)Mo(VI)等分离
硫酸盐沉淀 是消除大量Ba2+ ,Pb2+ ,Sr2+和硫酸根干扰的主要方法。 硫酸作沉淀剂,浓度不能太高,因易形成MHSO4盐加 大溶解度。沉淀碱土金属和Pb2+, CaSO4溶解度大,加入 乙醇降低溶解度。 卤化物沉淀 应用最多的是氟化稀土和各类卤化银沉淀 如:冰晶石法沉淀铝 在pH=4.5 Al(III)与NaF生成(NaAlF6 )沉淀,分离Al(III),与 Fe(III),Cr(III),Ni(II),V(V)Mo(VI)等分离
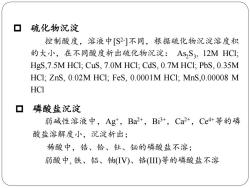
硫化物沉淀 控制酸度,溶液中[S2]不同,根据硫化物沉淀溶度积 的大小,在不同酸度析出硫化物沉淀:AsS3,12MHCI; HgS,7.5M HCI;CuS,7.0M HCI;CdS,0.7M HCI;PbS,0.35M HCI:ZnS,0.02M HCI:FeS,0.0001M HCI:MnS,0.00008 M HCI 磷酸盐沉淀 弱碱性溶液中,Ag,Ba2+,B3+,Ca+,Ce4+等的磷 酸盐溶解度小,沉淀析出; 稀酸中,锆、铪、钍、铋的磷酸盐不溶; 弱酸中,铁、铝、铀(IV)、铬()等的磷酸盐不溶
硫化物沉淀 控制酸度,溶液中[S2- ]不同,根据硫化物沉淀溶度积 的大小,在不同酸度析出硫化物沉淀: As2 S3 , 12M HCl; HgS,7.5M HCl; CuS, 7.0M HCl; CdS, 0.7M HCl; PbS, 0.35M HCl; ZnS, 0.02M HCl; FeS, 0.0001M HCl; MnS,0.00008 M HCl 磷酸盐沉淀 弱碱性溶液中,Ag+ ,Ba2+ ,Bi3+ ,Ca2+ ,Ce4+等的磷 酸盐溶解度小,沉淀析出; 稀酸中,锆、铪、钍、铋的磷酸盐不溶; 弱酸中, 铁、铝、铀(IV)、铬(III)等的磷酸盐不溶

B)有机沉淀剂 用有机沉淀剂进行分离,具有选择性高和生成的沉淀吸附 无机杂质少的优点,有机沉淀剂分为有机络合物沉淀剂和离子 络合物沉淀剂。 草酸:沉淀Ca,Sr,Ba,稀土(II),Th等 铜铁试剂(N-亚硝基苯基羟铵): 强酸中沉淀Cu,Fe,Zr,Ti,Ce,Th,V,Nb,Ta等; 微酸中沉淀Al,Zn,Co,Mn,Be,Th,Ga,In,Tl等。 主要用于1:9的疏酸介质中沉淀Fe(II),Ti(IV),V(V)等与 Al,Cr,Co,Ni分离 铜试剂(二乙胺基二硫代甲酸钠,DDTC) 沉淀Cu,Cd,Ag,Co,Ni,HgPb.Bi,Zn等重金属离子,与稀 土、碱土金属离子及铝等分开
B)有机沉淀剂 用有机沉淀剂进行分离,具有选择性高和生成的沉淀吸附 无机杂质少的优点,有机沉淀剂分为有机络合物沉淀剂和离子 络合物沉淀剂。 草酸: 沉淀Ca, Sr, Ba, 稀土(III), Th等 铜铁试剂(N-亚硝基苯基羟铵): 强酸中沉淀Cu,Fe,Zr,Ti,Ce,Th,V,Nb,Ta等; 微酸中沉淀Al,Zn,Co,Mn,Be,Th,Ga,In,Tl等。 主要用于1:9的硫酸介质中沉淀Fe(III),Ti(IV),V(V)等与 Al,Cr,Co,Ni分离 铜试剂 (二乙胺基二硫代甲酸钠,DDTC): 沉淀Cu,Cd,Ag,Co,Ni,Hg.Pb.Bi,Zn等重金属离子,与稀 土、碱土金属离子及铝等分开
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第10章 吸光光度法(Absorption Photometry).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第9章 重量分析法 Gravimetry(Gravimetric Analysis).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第8章 沉淀滴定法(Precipitation titrations).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第7章 氧化还原滴定法 Oxidation-Reduction Titration Redox titration.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第6章 络合滴定法.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第5章 酸碱滴定法.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第3章 分析化学中的误差与数据处理.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第2章 分析试样的采集与制备.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第1章 概论.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十二章 铁系元素和铂系元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十一章 铬副族元素和锰副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十章 钛副族元素和钒副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十九章 铜副族元素和锌副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十八章 氢和稀有气体.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十七章 卤素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十六章 氧族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十五章 氮族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十四章 碳族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十三章 硼族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十二章 碱金属和碱土金属.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第二章 滴定分析概论.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第三章 酸碱滴定.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第四章 非水酸碱滴定法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第五章 误差与分析数据的处理.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第七章 氧化还原滴定法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第七章 重量分析法、第八章 沉淀滴定与重量分析.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第六章 配位滴定法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十章 电位法和永停滴定法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十四章 紫外可见分光光度法(2/3)第三节 基本原理、第四节 紫外分光光度计.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十四章 紫外可见分光光度法(1/3)第一节 光学分析概论、第二节 紫外-可见吸收光谱.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(1/5)第一节 概述、第二节 红外分光光度法基本原理(1/2).ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(3/5)第二节 红外分光光度法基本原理(2/2).ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(3/5)第四节 各种化合物的典型光谱(1/2).ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(4/5)第四节 各种化合物的典型光谱(2/2).ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(5/5)第五节 红外光谱解析方法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十四章 紫外可见分光光度法(3/3)第五节 定性和定量分析.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十二章 气相色谱法(1/3)第一节 概述 第二节 气相色谱法的基本原理.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十二章 气相色谱法(2/3)第三节 气相色谱柱 第四节 检测器.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十二章 气相色谱法(3/3)第五节 分离条件的选择、第六节 定性定量分析.ppt
