信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十六章 氧族元素

第十六章氧族元素 ·16-1氧族元素的通性 。16-2氧、臭氧 ·16-3水 ·16-4过氧化氢 ·16-5疏和它的化合物 ·16-6无机酸强度的变化规律
第十六章 氧族元素 ⚫ 16-1 氧族元素的通性 ⚫ 16-2 氧、臭氧 ⚫ 16-3 水 ⚫ 16-4 过氧化氢 ⚫ 16-5 硫和它的化合物 ⚫ 16-6 无机酸强度的变化规律
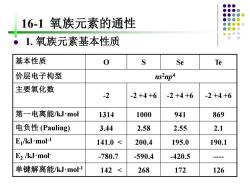
16-1氧族元素的通性 1.氧族元素基本性质 基本性质 0 S Se Te 价层电子构型 ns2np 主要氧化数 -2 -2+4+6 -2+4+6 -2+4+6 第一电离能kJ.mol 1314 1000 941 869 电负性(Pauling) 3.44 2.58 2.55 2.1 E/kJ-mol-1 141.0< 200.4 195.0 190.1 E2 /kJ.mol- -780.7 -590.4 -420.5 - 单键解离能/kJ.mol-1 142< 268 172 126
16-1 氧族元素的通性 ⚫ 1. 氧族元素基本性质 基本性质 O S Se Te 价层电子构型 ns2np4 主要氧化数 -2 -2 +4 +6 -2 +4 +6 -2 +4 +6 第一电离能/kJ·mol 1314 1000 941 869 电负性 (Pauling) 3.44 2.58 2.55 2.1 E1 /kJ·mol-1 141.0 < 200.4 195.0 190.1 E2 /kJ·mol- -780.7 -590.4 -420.5 - 单键解离能/kJ·mol-1 142 < 268 172 126

主族元素原子半径变化规律 。H 30 140 Be B C N 0 Li 0 152 111.3 86 77.2 70 66 64 154 CI Na D ⑧ 186 160 143.1 117 110 104 99 188 Ga Se B 232 197 135 128 121 117 114 202 248 215 167 151 145 142 133 216 265 217.3 170 175154.7164
主族元素原子半径变化规律

2.第二周期元素一氧的特殊性 1.氧化态:0基本为-2. 例外: -1 +1 +2 H202 02F2 OF2 2.E1:0<S 类似:F<CI 3.单键解离能 (1)自身成键 (E-E) O-0 S-S Se-Se Te-Te 142 264 172 kJ.mol-1
2. 第二周期元素—氧的特殊性 1. 氧化态:O基本为-2. 例外: -1 +1 +2 H2O2 O2F2 OF2 2. E1:O Se-Se > Te-Te 142 264 172 - kJ·mol-1

(2)与电负性较大、价电子数目较多的元素的原子成键 O-F S-F O-CI S-CI 190 326 205 255 kJ.mol-1 (3)与电负性较小、价电子数目较少的元素原子成键。 0-C(359)>S-C(272);0-H(467)>S-H374) 4.双键离解能 0=0(493.59kJmo1)>S=S(427.7kJmo1)
(2) 与电负性较大、价电子数目较多的元素的原子成键。 O-F S-C (272) ; O-H (467) > S-H(374) 4. 双键离解能 O=O (493.59 kJ·mol-1 ) > S=S (427.7 kJ·mol-1 )

5. 键型 多数氧化物为离子型,而硫化物、硒化物、碲化 物多数为共价型,仅IA、A化合物Na2S、BaS. 等为离子型。 6.配位数 中心原子周期 价轨道数 C.N.max 二 4 (2s2Px2py2p)4 H3O S 三 9 6 SF6
5.键型 多数氧化物为离子型,而硫化物、硒化物、碲化 物多数为共价型,仅IA、IIA化合物Na2S、BaS . 等为离子型。 6. 配位数 中心原子 周期 价轨道数 C.N.max O 二 4 (2s2px2py2pz ) 4 [H3O]+ S 三 9 6 SF6
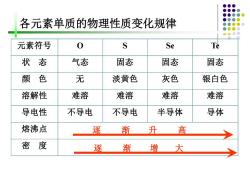
各元素单质的物理性质变化规律 元素符号 0 S Se Te 状态 气态 固态 固态 固态 颜色 无 淡黄色 灰色 银白色 溶解性 难溶 难溶 难溶 难溶 导电性 不导电 不导电 半导体 导体 熔沸点 逐渐 升高 密度 逐渐增大
各元素单质的物理性质变化规律 元素符号 O S Se Te 状 态 气态 固态 固态 固态 颜 色 无 淡黄色 灰色 银白色 溶解性 难溶 难溶 难溶 难溶 导电性 不导电 不导电 半导体 导体 熔沸点 密 度 逐 渐 升 高 逐 渐 增 大

16-2氧、臭氧 。2-1氧在自然界的分布 三种同位素示踪原子180,Ps70 ·2-2氧的制备和空气液化
16-2 氧、臭氧 ⚫ 2-1 氧在自然界的分布 三种同位素 示踪原子18O,P570 ⚫ 2-2 氧的制备和空气液化

2-3氧的结构、性质和用途 1. 氧分子形态0202022.02+022+ 02分子结构:VB法02s22p12p,12pz 02s22px12p,12pz2 即:0=0 似应为“逆磁”。 M0:02分子轨道式 uss斜 人寸〔2H2B.①8B.√T. 02分子成键: 1o+26 02分子顺磁
1. 氧分子形态 O2 O- 2 O2 2- O2 + O2 2+ ( 2)B.M. 2.83B.M. ( )( )( )( )( ) 1 ( 2 ) 2 1 2 2 2 2 2 2 2 2 2 2 2 2 1 2 1 + = nn px pz py pz py s s s s px = MO: O2分子轨道式 3 1+22 2-3 氧的结构、性质和用途 O2分子成键: O2分子结构:VB法 O 2s 2 2px 1 2py 1 2pz 2 | | O 2s 2 2px 1 2py 1 2pz 2 即: O=O 似应为“逆磁”。 O2分子顺磁

02022-02+022+ 3Aaa厚 ∠6②B.wB.Nat 人手季 L为2②B.©I 10 寸B.NB.4☑2 c6D元要
=( 2)B.M1.73B.M. O, :( )( )( )( )( ) 2 ( 2 ) 2 1 2 2 2 2 2 2 2 2 2 2 2 2 1 2 2 1 + = − nn MO px pz py pz py s s s s px =( 2)B.M0 O, :( )( )( )( )( ) 2 ( 2 ) 2 2 2 2 2 2 2 2 2 2 2 2 2 2 1 2 1 2 2 + = − nn MO px pz py pz py s s s s px =( 2)B.M1.73B.M. O, :( )( )( )( )( ) 1 ( 2 ) 2 0 2 2 2 2 2 2 2 2 2 2 2 2 1 2 1 + 2 + = nn MO px pz py pz py s s s s px =( 2)B.M0 O, :( )( )( )( )( ) 0 ( 2 ) 2 0 2 2 2 2 2 2 2 2 2 2 2 2 1 2 1 2+ 2 + = nn MO px pz py pz py s s s s px 1 3 1+2 3 2 2 1+12+1 2 1+22 O- 2 O2 2- O2 + O2 2+
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十五章 氮族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十四章 碳族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十三章 硼族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十二章 碱金属和碱土金属.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十一章 配位化学基础.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十章 氧化还原反应.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第六章 分子结构和共价键理论.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第九章 沉淀溶解平衡.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第八章 酸碱解离平衡.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第七章 晶体结构.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第五章 原子结构和元素周期律.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第四章 化学平衡.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第三章 化学反应速率.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二章 化学热力学基础.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第一章 化学基础知识.pptx
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第九章 红外光谱分析 第三节 红外光谱与分子结构.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第十节 薄板与纸层析.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第四节 分离条件选择.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第七章 色谱分析法 第五节 定性定量方法.ppt
- 内蒙古大学:《分析化学》课程教学资源(PPT课件)第五章 分光光度分析法 第二节 紫外可见分光光度法.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十七章 卤素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十八章 氢和稀有气体.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第十九章 铜副族元素和锌副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十章 钛副族元素和钒副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十一章 铬副族元素和锰副族元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十二章 铁系元素和铂系元素.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第1章 概论.pptx
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第2章 分析试样的采集与制备.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第3章 分析化学中的误差与数据处理.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第5章 酸碱滴定法.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第6章 络合滴定法.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第7章 氧化还原滴定法 Oxidation-Reduction Titration Redox titration.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第8章 沉淀滴定法(Precipitation titrations).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第9章 重量分析法 Gravimetry(Gravimetric Analysis).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第10章 吸光光度法(Absorption Photometry).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第11章 分析化学中常用的分离和富集方法.pptx
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第二章 滴定分析概论.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第三章 酸碱滴定.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第四章 非水酸碱滴定法.ppt
