沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十章 电位法和永停滴定法

第十章电位法和永停滴定法 第一节 电化学分析概述 1.电化学分析:根据被测溶液所呈现的电化学性质 及其变化而建立的分析方法 2.分类: 根据所测电池的电物理量性质不同分为 (1)电导分析法 (2)电解分析法 (3)电位分析法: 直接电位法,电位滴定法 (4)库仑分析法 (5)极谱分析法 (6)伏安分析法
第十章 电位法和永停滴定法 第一节 电化学分析概述 1.电化学分析:根据被测溶液所呈现的电化学性质 及其变化而建立的分析方法 2.分类: 根据所测电池的电物理量性质不同分为 (1)电导分析法 (2)电解分析法 (3)电位分析法:直接电位法,电位滴定法 (4)库仑分析法 (5)极谱分析法 (6)伏安分析法

续前 电位分析法:利用电极电位与化学电池电解质 溶液中某种组分浓度的对应关系而实现定量测 量的电化学分析法 3.特点: (1)准确度高, 重现性和稳定性好 (2)灵敏度高,104108mo/L 10-10~102mol/L(极谱,伏安) (3)选择性好(排除干扰) (4)应用广泛(常量、微量和痕量分析) (5)仪器设备简单,易于实现自动化
续前 电位分析法:利用电极电位与化学电池电解质 溶液中某种组分浓度的对应关系而实现定量测 量的电化学分析法 3.特点: (1)准确度高,重现性和稳定性好 (2)灵敏度高,10-4~10-8mol/L 10-10 ~10-12 mol/L(极谱,伏安) (3)选择性好(排除干扰) (4)应用广泛(常量、微量和痕量分析) (5)仪器设备简单,易于实现自动化

第二节电位法基本原理 几个概念 、 化学电池 三 可逆电极和可逆电池 四、指示电极和参比电极 五、电极电位的测量
第二节 电位法基本原理 一、几个概念 二、化学电池 三、可逆电极和可逆电池 四、指示电极和参比电极 五、电极电位的测量

几个概念 1 相界电位:两个不同物相接触的界面上的电位差 2. 液接电位:两个组成或浓度不同的电解质溶液相 接触的界面间所存在的微小电位差,称~。 3. 金属的电极电位:金属电极插入含该金属的电解 质溶液中产生的金属与溶液的相界电位,称~。 Zn→Zn+→双电层→动态平衡 →稳定的电位差 4. 电池电动势:构成化学电池的相互接触的各相界 电位的代数和,称~
一、几个概念 1.相界电位:两个不同物相接触的界面上的电位差 2.液接电位:两个组成或浓度不同的电解质溶液相 接触的界面间所存在的微小电位差,称~。 3.金属的电极电位:金属电极插入含该金属的电解 质溶液中产生的金属与溶液的相界电位,称~。 4.电池电动势:构成化学电池的相互接触的各相界 电位的代数和,称~。 Zn → Zn2+ 双电层 动态平衡 稳定的电位差

二、 化学电池: 种电化学反应器,由两个电极插入适当电解质 溶液中组成 (一)分类: 1.原电池 :将化学能转化为电能的装置(自发进行) 应用:直接电位法,电位滴定法 2」 电解池:将电能转化为化学能的装置(非自发进行) 应用:永停滴定法
二、化学电池: 一种电化学反应器,由两个电极插入适当电解质 溶液中组成 (一)分类: 1.原电池:将化学能转化为电能的装置(自发进行) 应用:直接电位法,电位滴定法 2.电解池:将电能转化为化学能的装置(非自发进行) 应用:永停滴定法

续前 电池的表示形式与电池的电极反应 1. 表示形式: 1)溶液注明活度 2)用【表示电池组成的每个接界面 3)用表示盐桥,表明具有两个接界面 4)发生氧化反应的一极写在左 发生还原反应的一极写在右
续前 (二)电池的表示形式与电池的电极反应 1.表示形式: 1)溶液注明活度 2)用︱表示电池组成的每个接界面 3)用‖表示盐桥,表明具有两个接界面 4)发生氧化反应的一极写在左 发生还原反应的一极写在右

Daniel电池 铜锌电池结构 2.原电池: (Zn Zn2+(1mol/L)I Cu2+(1mol/L)Cu (+ Paur/cu =0.377W z÷/a=-0.7637 电极反应 (-)Zn极 Zn-2e÷Zn2t (氧化反应) (+)Cu极 Cu2+2e -Cu (还原反应》 电池反应 Zn+Cu2+÷Zn2++Cu (氧化还原反应) E=中-中+E,+(有液接电位) E=,-中=0.337-(-0.763)=1.100(无液接电位)
Daniel 电池——铜锌电池结构 2.原电池: (-) Zn ︱Zn2+ (1mol/L)‖ Cu2+ (1mol/L)︱Cu (+) V Cu Cu 2+ = 0.377 V Zn Zn 2+ = −0.763 电极反应 (-)Zn极 Zn – 2e Zn2+ (氧化反应) (+)Cu极 Cu2+ + 2e Cu (还原反应) 电池反应 Zn + Cu2+ Zn2+ + Cu (氧化还原反应) E = + − − + Ej +(有液接电位) E = + − − = 0.337 − (−0.763) =1.100(无液接电位)
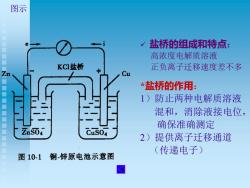
图示 √盐桥的组成和特点: 高浓度电解质溶液 KCl盐桥 正负离子迁移速度差不多 *盐桥的作用: 1)防止两种电解质溶液 混和,消除液接电位, 确保准确测定 ZnS04 CuSo4 2)提供离子迁移通道 (传递电子) 图10-1铜锌原电池示意图
图示 ✓ 盐桥的组成和特点 : 高浓度电解质溶液 正负离子迁移速度差不多 *盐桥的作用 : 1 )防止两种电解质溶液 混和,消除液接电位, 确保准确测定 2 )提供离子迁移通道 (传递电子)

续前 3.电解池: (阳)Cu|Cu2+(1mol/L)IZn2+(1mo/L)|Zn(阴〉 电极反应—外加电压 (阴极)Zn极 Zn2++2e= Zn (还原反应 (阳极)Cu极 Cu 2e ÷Cu2+ (氧化反应 电池反应 Zn++Cu二Zn+Cu+(被动氧化还原反应)
续前 3.电解池: (阳)Cu ︱Cu2+ (1mol/L)‖ Zn2+ (1mol/L)︱Zn (阴) 电极反应——外加电压 (阴极)Zn极 Zn2+ + 2e Zn (还原反应) (阳极)Cu极 Cu - 2e Cu 2+ (氧化反应) 电池反应 Zn2+ + Cu Zn + Cu2+ (被动氧化还原反应)

三、可逆电极和可逆电池 可逆电极:无限小电流通过时,电极反应可逆 可逆电池:由两个可逆电极组成
三、可逆电极和可逆电池 ◼ 可逆电极:无限小电流通过时,电极反应可逆 ◼ 可逆电池:由两个可逆电极组成
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第六章 配位滴定法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第七章 重量分析法、第八章 沉淀滴定与重量分析.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第七章 氧化还原滴定法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第五章 误差与分析数据的处理.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第四章 非水酸碱滴定法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第三章 酸碱滴定.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第二章 滴定分析概论.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第11章 分析化学中常用的分离和富集方法.pptx
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第10章 吸光光度法(Absorption Photometry).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第9章 重量分析法 Gravimetry(Gravimetric Analysis).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第8章 沉淀滴定法(Precipitation titrations).ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第7章 氧化还原滴定法 Oxidation-Reduction Titration Redox titration.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第6章 络合滴定法.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第5章 酸碱滴定法.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第3章 分析化学中的误差与数据处理.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第2章 分析试样的采集与制备.ppt
- 信阳师范大学(信阳师范学院):《分析化学》课程教学资源(PPT课件)第1章 概论.pptx
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十二章 铁系元素和铂系元素.ppt
- 信阳师范大学:《无机化学》课程电子教案(PPT教学课件)第二十一章 铬副族元素和锰副族元素.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十四章 紫外可见分光光度法(2/3)第三节 基本原理、第四节 紫外分光光度计.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十四章 紫外可见分光光度法(1/3)第一节 光学分析概论、第二节 紫外-可见吸收光谱.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(1/5)第一节 概述、第二节 红外分光光度法基本原理(1/2).ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(3/5)第二节 红外分光光度法基本原理(2/2).ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(3/5)第四节 各种化合物的典型光谱(1/2).ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(4/5)第四节 各种化合物的典型光谱(2/2).ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十五章 红外分光光度法(5/5)第五节 红外光谱解析方法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十四章 紫外可见分光光度法(3/3)第五节 定性和定量分析.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十二章 气相色谱法(1/3)第一节 概述 第二节 气相色谱法的基本原理.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十二章 气相色谱法(2/3)第三节 气相色谱柱 第四节 检测器.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十二章 气相色谱法(3/3)第五节 分离条件的选择、第六节 定性定量分析.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十一章 色谱分析概论和经典液相色谱.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)第十三章 高效液相色谱法.ppt
- 沈阳药科大学:《分析化学》课程教学资源(PPT课件)经典液相色谱法.ppt
- 石河子大学:《分析化学》课程教学资源(教学大纲)分析化学及实验教学大纲.pdf
- 石河子大学:《分析化学》课程教学资源(教学大纲)水分析化学教学大纲 Water analytical chemistry(负责人:齐誉).pdf
- 石河子大学:《分析化学》课程教学资源(教学大纲)药学专业分析化学课程教学大纲(负责人:赵芳).doc
- 石河子大学:《分析化学》课程教学教学大纲 Analytical Chemistry(化学、化学工程与工艺、应用化学、环境工程).doc
- 石河子大学:《分析化学》课程教学大纲 Analytical Chemistry.doc
- 石河子大学:《分析化学》课程教学资源(授课教案)2012年分析化学教案(任课教师:曹红).pdf
