济源职业技术学院:《无机及分析化学》课程教学资源(PPT课件)第二章 化学反应速率与化学平衡

第二章化学反应速率与化学平衡 化学反应速率 影响化学反应速率的因素 之 化学平衡移动 影响平衡移动的因素
第二章 化学反应速率与化学平衡 化学平衡移动 化学反应速率 影响平衡移动的因素 影响化学反应速率的因素

2.1化学反应速率 化学反应速率的表示方法 平均速率 对化学反应,若在一定条件下,单位时间内反应 物的减少或生成物的增加 单位:mol.L1.时间
一、化学反应速率的表示方法 2.1 化学反应速率 1 平均速率 对化学反应,若在一定条件下,单位时间内反应 物的减少或生成物的增加 2 1 2 1 i c c c v t t t − − = = − 单位:mol.L-1 .时间
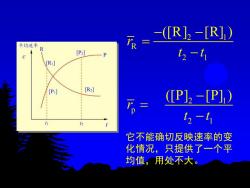
平均速率 万=R2-R]) R [P] t2-t1 R [P:] [R] (P]2-[P]) t2-t1 h 它不能确切反映速率的变 化情况,只提供了一个平 均值,用处不大
2 1 R 2 1 2 1 p 2 1 ([R] [R] ) ([P] [P] ) r t t r t t − − = − − = − 它不能确切反映速率的变 化情况,只提供了一个平 均值,用处不大
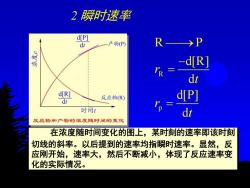
2瞬时速率 d[P] 产物(P) R >P dR dt d[R] 反应物(R) d[P] dt 时间1 反应物和产物的浓度随时间的变化 在浓度随时间变化的图上,某时刻的速率即该时刻 切线的斜率。以后提到的速率均指瞬时速率。显然,反 应刚开始,速率大,然后不断减小,体现了反应速率变 化的实际情况
2 瞬时速率 在浓度随时间变化的图上,某时刻的速率即该时刻 切线的斜率。以后提到的速率均指瞬时速率。显然,反 应刚开始,速率大,然后不断减小,体现了反应速率变 化的实际情况。 R p R P d[R] d d[P] d r t r t ⎯⎯→ − = =

●在浓度随时间变化的图上,某时刻的速 率即该时刻切线的斜率。以后提到的速率 均指瞬时速率。显然,反应刚开始,速率 大,然后不断减小,体现了反应速率变化 的实际情况。 ●反应是中各物质的化学计量数往往不同, 用不同的反应物或生成物的浓度变化所得的 反应速率,数值上可能不同。为统一起见, 根据国家标准,可将所得反应速率除以各物 质在反应式中的计量系数
⚫在浓度随时间变化的图上,某时刻的速 率即该时刻切线的斜率。以后提到的速率 均指瞬时速率。显然,反应刚开始,速率 大,然后不断减小,体现了反应速率变化 的实际情况。 ⚫反应是中各物质的化学计量数往往不同, 用不同的反应物或生成物的浓度变化所得的 反应速率,数值上可能不同。为统一起见, 根据国家标准,可将所得反应速率除以各物 质在反应式中的计量系数

如:化学反应: aA+bB=gG+dD 化学反应速率为: 1 dc(A1 de(B 1 de(G 1 dc(D) b dtg dt d dt
如:化学反应: aA + bB = gG + dD 化学反应速率为:

反应速率: ①某一时刻的反应速率、瞬时速率; ②平均速率的极限即为瞬时速率; ③用反应中的任何物质表示反应速率, 数值上都是一样的; 瞬时速率的测定可以由作图法得到
反应速率: ① 某一时刻的反应速率、瞬时速率; ②平均速率的极限即为瞬时速率; ③用反应中的任何物质表示反应速率, 数值上都是一样的; ④ 瞬时速率的测定可以由作图法得到

2.2化学反应速率理论简介 1、化学反应历程(机理) 个化学反应,在一定条件下,反应物变成生成物 实际经过的途径: 基元反应:在反应中反应物分子直接转化成生成物的反 应一简单反应 复杂反应:在反应中反应物分子经过多步才转化成生成 物的反应非基元反应
2.2 化学反应速率理论简介 1、化学反应历程(机理) 一个化学反应,在一定条件下,反应物变成生成物 实际经过的途径: 基元反应:在反应中反应物分子直接转化成生成物的反 应—简单反应 复杂反应:在反应中反应物分子经过多步才转化成生成 物的反应-非基元反应

基元反应 CO(g)+NO2(g)CO2(g)+NO(g) 非基元反应 H2(g)+I2(g)2HI(g) I2(g)=2I(g) 快 H2(g)+2I(g)2HI(g) 慢
CO(g) + NO2 (g) = CO2 (g) + NO(g) 基元反应 非基元反应 H2 (g) + I2 (g) = 2HI(g) I2 (g) =2 I(g) H2 (g) + 2I(g) = 2HI(g) 慢 快

2、化学反应速率理论 (1)有效碰撞理论 化学反应发生的必要条件是反应物分 子 (或原子、离子)间的碰撞。 只有极少数活化分子的碰撞才能发生化学 反应,称“有效碰撞”;活化分子是反应物 分子中能量较高的分子,其比例很小;
2、化学反应速率理论 化学反应发生的必要条件是反应物分 子(或原子、离子)间的碰撞。 只有极少数活化分子的碰撞才能发生化学 反应,称“有效碰撞”;活化分子是反应物 分子中能量较高的分子,其比例很小; (1)有效碰撞理论
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 济源职业技术学院:《无机及分析化学》课程教学资源(教案讲义)第二章 化学反应速率与化学平衡.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(PPT课件)第九章 配位平衡和配位滴定法.ppt
- 济源职业技术学院:《无机及分析化学》课程教学资源(教案讲义)第九章 配位平衡和配位滴定法.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(教案讲义)第三章 原子结构和元素周期表.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(PPT课件)第七章 重量分析法和沉淀滴定法.ppt
- 济源职业技术学院:《无机及分析化学》课程教学资源(教案讲义)第七章 重量分析法和沉淀滴定法.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(PPT课件)第一章 气体与热化学方程式.ppt
- 济源职业技术学院:《无机及分析化学》课程教学资源(教案讲义)第一章 气体与热化学方程式.doc
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第十六章 氨基酸、多肽和蛋白质.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第十五章 碳水化合物.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第十四章 对映异构.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第十二章 含氮化合物.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第十一章 丙二酸二乙酯和乙酰乙酸乙酯.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第十章 羧酸及其衍生物.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第九章 醛和酮.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第八章 醇酚醚.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第六章 芳香烃.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第五章 脂环烃.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第四章 炔烃.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第三章 烯烃和二烯烃.ppt
- 济源职业技术学院:《无机及分析化学》课程教学资源(教案讲义)第五章 分析化学概论.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(PPT课件)第五章 分析化学概论.ppt
- 济源职业技术学院:《无机及分析化学》课程教学资源(PPT课件)第八章 氧化还原反应和氧化还原滴定法.ppt
- 济源职业技术学院:《无机及分析化学》课程教学资源(教案讲义)第六章 酸碱平衡和酸碱滴定法.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(PPT课件)第十一章 金属元素.ppt
- 济源职业技术学院:《无机及分析化学》课程教学资源(教案讲义)第十章 吸光光度法.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(PPT课件)第十章 吸光光度法.ppt
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)无机及分析化学实验常用实验仪器.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)无机及分析化学实验的目的和学习要求.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)化学实验操作的学习方法.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)化学实验的安全防护.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验室规则.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验二 分析天平的使用.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验三 酒精喷灯的使用和玻璃操作.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验四 滴定分析仪器的使用.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验五 气体的发生、净化、干燥与吸收.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验六 粗食盐提纯.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验七 缓冲溶液的配制与性能.doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验八 电解质溶液(微型实验).doc
- 济源职业技术学院:《无机及分析化学》课程教学资源(实验指导)实验九 酸碱标准溶液的配制和比较滴定.doc
