山东师范大学:《酶工程》课程教学资源(PPT课件)第五章 酶分子的化学修饰、第六章 酶的蛋白质工程

第五章 酶分子的化学修饰 • 酶的活性中心 • 酶化学修饰的目的 • 酶化学修饰的原理 • 酶化学修饰的设计 • 酶化学修饰的应用
第五章 酶分子的化学修饰 • 酶的活性中心 • 酶化学修饰的目的 • 酶化学修饰的原理 • 酶化学修饰的设计 • 酶化学修饰的应用

第一节 酶的活性中心(active site) 一、活性中心的概念 ❖酶的必需基团(essential group): 与酶活性有关的基团 ❖酶的活性中心(active center): 由必需基团构成的与酶催化活性有关的特 定区域
第一节 酶的活性中心(active site) 一、活性中心的概念 ❖酶的必需基团(essential group): 与酶活性有关的基团 ❖酶的活性中心(active center): 由必需基团构成的与酶催化活性有关的特 定区域
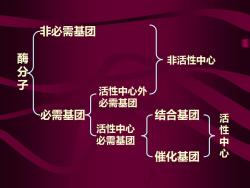
酶 分 子 非必需基团 必需基团 活性中心 必需基团 活性中心外 必需基团 结合基团 催化基团 非活性中心 活 性 中 心
酶 分 子 非必需基团 必需基团 活性中心 必需基团 活性中心外 必需基团 结合基团 催化基团 非活性中心 活 性 中 心

活性中心的重要化学基团 7种氨基酸出现的频率最高 Lys Asp Glu Cys His Tyr Ser (兰天果拌猪肉丝) 某些功能基团,如(氨基、羧基、巯基、羟基 和咪唑基)是酶的必需基团。 赖氨酸的氨基 天冬氨酸和谷氨酸的羧基 半胱氨酸的巯基 组氨酸的咪唑基 酪氨酸和丝氨酸的羟基
活性中心的重要化学基团 7种氨基酸出现的频率最高 Lys Asp Glu Cys His Tyr Ser (兰天果拌猪肉丝) 某些功能基团,如(氨基、羧基、巯基、羟基 和咪唑基)是酶的必需基团。 赖氨酸的氨基 天冬氨酸和谷氨酸的羧基 半胱氨酸的巯基 组氨酸的咪唑基 酪氨酸和丝氨酸的羟基
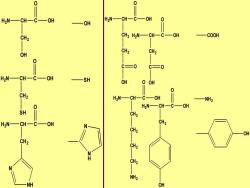
H2N CH C CH2 OH O OH OH H2N CH C CH2 OH O SH SH H2N CH C CH2 OH O N NH N N H H2N CH C CH2 OH O CH2 C OH O H2N CH C CH2 OH O C OH O COOH H2N CH C CH2 OH O CH2 CH2 CH2 NH2 NH2 H2N CH C CH2 OH O OH OH
H2N CH C CH2 OH O OH OH H2N CH C CH2 OH O SH SH H2N CH C CH2 OH O N NH N N H H2N CH C CH2 OH O CH2 C OH O H2N CH C CH2 OH O C OH O COOH H2N CH C CH2 OH O CH2 CH2 CH2 NH2 NH2 H2N CH C CH2 OH O OH OH
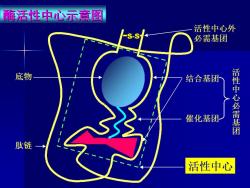
酶活性中心示意图 活性中心外 必需基团 底物 结合基团 催化基团 活性中心必需基团 肽链 活性中心

与底物相 结合,使底 物与酶的一 定构象形成 复合物 影响底物中某些 化学键的稳定, 催化底物发生化 学反应并将其转 化成产物 维持酶活 性中心应 有空间构 象所必需 的基团
与底物相 结合,使底 物与酶的一 定构象形成 复合物 影响底物中某些 化学键的稳定, 催化底物发生化 学反应并将其转 化成产物 维持酶活 性中心应 有空间构 象所必需 的基团

二、活性中心的共性 (1)活性部位只占酶分子很小的一部分(1-2%)。 (2)活性部位是一个三维实体。 (3)活性中心位于酶分子表面的疏水性裂缝中。 (4)活性中心构象不是固定不变的(诱导契合)。 (5)酶与底物通过盐键、氢键、范德华力和疏水作 用等次级键结合
二、活性中心的共性 (1)活性部位只占酶分子很小的一部分(1-2%)。 (2)活性部位是一个三维实体。 (3)活性中心位于酶分子表面的疏水性裂缝中。 (4)活性中心构象不是固定不变的(诱导契合)。 (5)酶与底物通过盐键、氢键、范德华力和疏水作 用等次级键结合
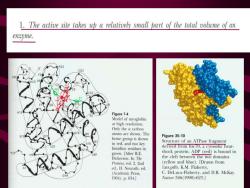
1.The active site takes up a relatively small part of the total volume of an enzyme. FG2 D2 Figure 7-4 Model of myoglobin at high resolution. Only the a carbon atoms are shown.The Figure 35-10 heme group is shown in red,and two key Structure of an ATPase fragment histidine residues in derived from hsc70,a cytosolic heat- green.[After R.E shock protein.ADP(red)is bound in Dickerson.In The the cleft between the two domains Proteins,vol.2.2nd (yellow and blue).[Drawn from ed.H.Neurath.ed. lats.pdb.K.M.Flaherty, (Academic Press. C.DeLuca-Flaherty,and D.B.McKay. GH 1964.p.684J Nate346(1990):623.]

A Chymotrypsin Figure 8-21
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 山东师范大学:《酶工程》课程教学资源(PPT课件)第三章 酶、细胞、原生质体固定化.ppt
- 山东师范大学:《酶工程》课程教学资源(PPT课件)第二章 酶的生物合成与发酵生产.ppt
- 山东师范大学:《酶工程》课程教学资源(PPT课件)第一章 绪论 Enzyme Engineering(主讲:赵蕾).ppt
- 山东师范大学:《分子生物学实验》课程教学课件(PPT讲稿)实验七 聚合酶链式反应(PCR)技术.ppt
- 山东师范大学:《分子生物学实验》课程教学课件(PPT讲稿)实验六 转化及重组子的筛选.ppt
- 山东师范大学:《分子生物学实验》课程教学课件(PPT讲稿)实验五 大肠杆菌感受态的制备(CaCl2法).ppt
- 山东师范大学:《分子生物学实验》课程教学课件(PPT讲稿)实验四 DNA片段的连接(向质粒载体中插入外源DNA).ppt
- 山东师范大学:《分子生物学实验》课程教学课件(PPT讲稿)实验二 质粒的酶切、琼脂糖凝胶电泳分离DNA.ppt
- 山东师范大学:《分子生物学实验》课程教学课件(PPT讲稿)实验一 质粒的提取(碱法).ppt
- 山东师范大学:《分子生物学》课程教学资源(PPT课件)第九章 遗传重组.ppt
- 山东师范大学:《分子生物学》课程教学资源(PPT课件)第八章 真核生物基因表达调控.ppt
- 山东师范大学:《分子生物学》课程教学资源(PPT课件)第七章 原核生物基因表达调控.ppt
- 山东师范大学:《分子生物学》课程教学资源(PPT课件)第六章 蛋白质的生物合成.ppt
- 山东师范大学:《分子生物学》课程教学资源(PPT课件)第五章 转录(transcription).ppt
- 山东师范大学:《分子生物学》课程教学资源(PPT课件)第四章 DNA的复制.ppt
- 山东师范大学:《分子生物学》课程教学资源(PPT课件)第三章 染色体和基因.ppt
- 山东师范大学:《分子生物学》课程教学资源(PPT课件)第二章 遗传的物质基础(DNA).ppt
- 山东师范大学:《分子生物学》课程教学资源(PPT课件)第一章 绪论 Molecular Biology(授课人:袁金铎).ppt
- 山东师范大学:《分子生物学》课程教学资源(PPT课件)第十一章 DNA损伤、修复和基因突变.ppt
- 山东师范大学:《分子生物学》课程教学资源(PPT课件)第十章 转座.ppt
- 山东师范大学:《酶工程》课程教学资源(PPT课件)第七章 酶反应器.ppt
- 山东师范大学:《酶工程》课程教学资源(PPT课件)第八章 抗体酶、核酶及极端酶.ppt
- 山东师范大学:《生态学》课程教学资源(PPT课件)绪论(主讲:付荣恕).ppt
- 山东师范大学:《生态学》课程教学资源(PPT课件)生态学实验(共六个).ppt
- 山东师范大学:《生态学》课程教学资源(PPT课件)第一章 生物与环境.ppt
- 山东师范大学:《生态学》课程教学资源(PPT课件)第二章 种群生态学.ppt
- 山东师范大学:《生态学》课程教学资源(PPT课件)第三章 群落生态学.ppt
- 山东师范大学:《生态学》课程教学资源(PPT课件)第五章 农业生态学.ppt
- 山东师范大学:《生态学》课程教学资源(PPT课件)第七章 人类生态学(human ecology).ppt
- 山东师范大学:《生态学》课程教学资源(PPT课件)第八章 污染生态学.ppt
- 山东师范大学:《细胞工程》课程教学资源(PPT课件)第一章 绪论 Cell Engineering.ppt
- 山东师范大学:《细胞工程》课程教学资源(PPT课件)第二章 细胞工程的理论基础.ppt
- 山东师范大学:《细胞工程》课程教学资源(PPT课件)第四章 细胞融合与单克隆抗体.ppt
- 山东师范大学:《细胞工程》课程教学资源(PPT课件)第七章 干细胞研究及其应用.ppt
- 山东师范大学:《细胞工程》课程教学资源(PPT课件)第八章 染色体工程.ppt
- 山东师范大学:《细胞工程》课程教学资源(PPT课件)第九章 胚胎工程.ppt
- 山东师范大学:《细胞生物学》课程教学资源(PPT课件)第十章 细胞骨架(Cytoskeleton).ppt
- 山东师范大学:《细胞生物学》课程教学资源(PPT课件)第十一章 细胞增殖及其调控 cell proliferation and cell cycle control.ppt
- 山东师范大学:《细胞生物学》课程教学资源(PPT课件)第十二章 细胞分化 Cell Differentiation.ppt
- 山东师范大学:《细胞生物学》课程教学资源(PPT课件)第十三章 细胞衰老与凋亡.ppt
