山东师范大学:《微生物工程》课程教学资源(PPT课件)第七章 气液质量传递

第 七 章 气 液 质 量 传 递
第 七 章 气 液 质 量 传 递

◆ 微生物反应体系中气液传质举例 需氧培养中的氧传递 以气态烃为碳源的微生物的培养 光合微生物培养中O2和CO2 的传递 氢利用菌中H2、O2、CO2的传递 固氮微生物对N2的利用 在好气性微生物反应中,传质的关键性问题是氧 的传递
◆ 微生物反应体系中气液传质举例 需氧培养中的氧传递 以气态烃为碳源的微生物的培养 光合微生物培养中O2和CO2 的传递 氢利用菌中H2、O2、CO2的传递 固氮微生物对N2的利用 在好气性微生物反应中,传质的关键性问题是氧 的传递

第一节 氧的溶解和微生物的耗氧
第一节 氧的溶解和微生物的耗氧

一、 氧在液体中的溶解 1、溶解氧(DO; Dissolved Oxygen) ◇ 作为环境因素对微生物反应有直接影响; ◇ 被好氧性微生物吸收消耗,并直接参与生长代谢过程, 可视为一种营养性底物
一、 氧在液体中的溶解 1、溶解氧(DO; Dissolved Oxygen) ◇ 作为环境因素对微生物反应有直接影响; ◇ 被好氧性微生物吸收消耗,并直接参与生长代谢过程, 可视为一种营养性底物

◆ 难溶:25°C、一个大气压,空气中的O2在纯水 中的溶解度仅0.25mol/m3。发酵液中含有各种成分, 其溶解度更低。 ◆ 对于菌体浓度为1015个/m3的发酵液,假定每个菌体的 体积为10-16 m3,细胞的呼吸强度为2.6×10-3 molO2/(kgs), 菌体密度为1000 kg/m3,含水量80%,则每立方米培养液的 需氧量为: 10-16×1015×1000×0.2 × 2.6×10-3 =0.052 molO2/(m3·s) ◆ 0.25 ÷ 0.052 = 4.8 (s) 培养液中的溶解氧最多可用4.8秒,因此必须连续通气
◆ 难溶:25°C、一个大气压,空气中的O2在纯水 中的溶解度仅0.25mol/m3。发酵液中含有各种成分, 其溶解度更低。 ◆ 对于菌体浓度为1015个/m3的发酵液,假定每个菌体的 体积为10-16 m3,细胞的呼吸强度为2.6×10-3 molO2/(kgs), 菌体密度为1000 kg/m3,含水量80%,则每立方米培养液的 需氧量为: 10-16×1015×1000×0.2 × 2.6×10-3 =0.052 molO2/(m3·s) ◆ 0.25 ÷ 0.052 = 4.8 (s) 培养液中的溶解氧最多可用4.8秒,因此必须连续通气

氧的饱和浓度单位:mmol O2/L, mg O2/L, ppm 或大气压 气体和溶液接触一定时间后,气体分子在气-液二相中的 浓度,就会达到动态平衡,此时溶解到溶液中的气体分子 数等于逸出溶液的气体分子数。若外界条件不变,气体在 溶液中的浓度就不再随时间而变化,此浓度为饱和浓度或 平衡浓度 2、饱和浓度
氧的饱和浓度单位:mmol O2/L, mg O2/L, ppm 或大气压 气体和溶液接触一定时间后,气体分子在气-液二相中的 浓度,就会达到动态平衡,此时溶解到溶液中的气体分子 数等于逸出溶液的气体分子数。若外界条件不变,气体在 溶液中的浓度就不再随时间而变化,此浓度为饱和浓度或 平衡浓度 2、饱和浓度

3、影响饱和浓度值的因素 1)温度 随着温度升高,气体分 子运动加快,使饱和浓 度下降。 在1个大气压及不同温度 下纯氧在水中的溶解度(mmol/L) 温度 (ºC) 溶解度 0 2.18 10 1.70 15 1.54 20 1.38 25 1.26 30 1.16 35 1.09 40 1.03
3、影响饱和浓度值的因素 1)温度 随着温度升高,气体分 子运动加快,使饱和浓 度下降。 在1个大气压及不同温度 下纯氧在水中的溶解度(mmol/L) 温度 (ºC) 溶解度 0 2.18 10 1.70 15 1.54 20 1.38 25 1.26 30 1.16 35 1.09 40 1.03

当纯水与一个大气压的空气相平衡时,温度对氧 饱和浓度的影响也可用下列经验公式来计算(适用 浓度为4~33ºC) C* = 14.68/ (31.6 + t) C* -与1个大气压空气相平衡的水中氧的饱和浓度,mol/m3 t-溶液的温度,ºC
当纯水与一个大气压的空气相平衡时,温度对氧 饱和浓度的影响也可用下列经验公式来计算(适用 浓度为4~33ºC) C* = 14.68/ (31.6 + t) C* -与1个大气压空气相平衡的水中氧的饱和浓度,mol/m3 t-溶液的温度,ºC
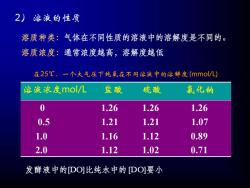
2) 溶液的性质 溶质种类:气体在不同性质的溶液中的溶解度是不同的。 溶质浓度:通常浓度越高,溶解度越低 溶液浓度mol/L 盐酸 硫酸 氯化钠 0 1.26 1.26 1.26 0.5 1.21 1.21 1.07 1.0 1.16 1.12 0.89 2.0 1.12 1.02 0.71 在25℃、一个大气压下纯氧在不同溶液中的溶解度(mmol/L) 发酵液中的[DO]比纯水中的[DO]要小
2) 溶液的性质 溶质种类:气体在不同性质的溶液中的溶解度是不同的。 溶质浓度:通常浓度越高,溶解度越低 溶液浓度mol/L 盐酸 硫酸 氯化钠 0 1.26 1.26 1.26 0.5 1.21 1.21 1.07 1.0 1.16 1.12 0.89 2.0 1.12 1.02 0.71 在25℃、一个大气压下纯氧在不同溶液中的溶解度(mmol/L) 发酵液中的[DO]比纯水中的[DO]要小

在系统总分压小于5个大气压的情况下,氧的溶解度与总 压和其他气体的分压无关,只与氧分压成直线相关,可用 Henry定律表示: C* = PO2/H 3)氧分压 C* — 与气相PO2达平衡时溶液中的氧浓度,mmolO2/L PO2 — 氧分压, Pa H — Henry常数(与溶液性质、温度等有关),Pa·L/mmolO2 气相中氧浓度增加,溶液中溶氧浓度亦随之增加,必 要时可向发酵液中通入纯氧以提高溶氧
在系统总分压小于5个大气压的情况下,氧的溶解度与总 压和其他气体的分压无关,只与氧分压成直线相关,可用 Henry定律表示: C* = PO2/H 3)氧分压 C* — 与气相PO2达平衡时溶液中的氧浓度,mmolO2/L PO2 — 氧分压, Pa H — Henry常数(与溶液性质、温度等有关),Pa·L/mmolO2 气相中氧浓度增加,溶液中溶氧浓度亦随之增加,必 要时可向发酵液中通入纯氧以提高溶氧
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)第五章 灭菌工程及空气净化、第六章 种子扩大培养.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)第四章 生物反应器(发酵罐).ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)第三章 发酵培养基.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)第二章 菌种来源.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)第十三章 发酵实例.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)第十二章 微生物工程下游工程简介.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)第十一章 基因工程与固定化细胞.ppt
- 齐齐哈尔大学:《植物生理学》课程教学资源(PPT课件)第九章 植物的成花生理.ppt
- 齐齐哈尔大学:《植物生理学》课程教学资源(实验指导)实验 9 植物叶绿素的分离制备.doc
- 齐齐哈尔大学:《植物生理学》课程教学资源(PPT课件)第八章 植物的营养生长.ppt
- 齐齐哈尔大学:《植物生理学》课程教学资源(实验指导)实验 8 叶绿体色素的定量测定.doc
- 齐齐哈尔大学:《植物生理学》课程教学资源(PPT课件)第七章 植物生长物质.ppt
- 齐齐哈尔大学:《植物生理学》课程教学资源(实验指导)实验 7 叶绿体色素的提取、分离和理化性质.doc
- 齐齐哈尔大学:《植物生理学》课程教学资源(PPT课件)第六章 植物体内同化物的运输与分配.ppt
- 齐齐哈尔大学:《植物生理学》课程教学资源(实验指导)实验 6 植物体内硝酸还原酶活力的测定.doc
- 齐齐哈尔大学:《植物生理学》课程教学资源(PPT课件)第五章 植物的光合作用.ppt
- 齐齐哈尔大学:《植物生理学》课程教学资源(实验指导)实验 5 植物根系活力的测定(TTC法).doc
- 齐齐哈尔大学:《植物生理学》课程教学资源(PPT课件)第四章 植物的呼吸作用.ppt
- 齐齐哈尔大学:《植物生理学》课程教学资源(实验指导)实验 4 植物组织水势的测定(小液流法).doc
- 齐齐哈尔大学:《植物生理学》课程教学资源(PPT课件)第三章 植物的矿质与氮素营养.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)第八章 发酵操作方式及发酵动力学.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)第九章 发酵工艺控制.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)第十章 发酵过程的参数检测.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)实验一 从土壤中分离纯化蛋白酶产生菌.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)实验二 淀粉酶产生菌的紫外线诱变育种.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)实验三 米曲霉固体发酵制曲.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)实验四 苏云金杆菌(Bacillus thuringiensis)摇瓶发酵.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)实验五 发酵罐认知及链霉素发酵.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)实验六 柠檬酸摇瓶发酵及提取.ppt
- 山东师范大学:《微生物工程》课程教学资源(PPT课件)实验八 酵母细胞固定化及其乙醇发酵.ppt
- 沈阳农业大学:《植物生理学》课程教学资源(PPT课件)植物生理学绪论.ppt
- 沈阳农业大学:《植物生理学》课程教学资源(PPT课件)第一章 植物的水分生理.ppt
- 沈阳农业大学:《植物生理学》课程教学资源(PPT课件)第二章 植物的矿质营养.ppt
- 沈阳农业大学:《植物生理学》课程教学资源(PPT课件)第三章 光合作用.ppt
- 沈阳农业大学:《植物生理学》课程教学资源(PPT课件)第四章 呼吸作用.ppt
- 沈阳农业大学:《植物生理学》课程教学资源(PPT课件)第五章 植物体内同化物运输与分配.ppt
- 沈阳农业大学:《植物生理学》课程教学资源(PPT课件)第六章 植物细胞信号转导及生长物质.ppt
- 沈阳农业大学:《植物生理学》课程教学资源(PPT课件)第七章 植物的生长与运动.ppt
- 沈阳农业大学:《植物生理学》课程教学资源(PPT课件)第八章 植物的成花生理和生殖生理.ppt
- 沈阳农业大学:《植物生理学》课程教学资源(PPT课件)第九章 植物的成熟与衰老生理.ppt
